|
||||
|
|
Раздел I ДИАГНОСТИКА, ЛЕЧЕНИЕ И ПРОФИЛАКТИКА НЕКОТОРЫХ ЗАБОЛЕВАНИЙ У ДЕТЕЙ В ДОМЕ РЕБЕНКА  ГЛАВА 1. Выхаживание недоношенных и маловесных детей в условиях дома ребенка В настоящее время, согласно рекомендациям Всемирной Организации Здравоохранения, термин «недоношенный» применяется для детей, рожденных при сроке беременности до 37 полных недель и имеющих все признаки незрелости. Недонашивание – это самопроизвольное и индуцированное прерывание беременности со сроков, когда плод считается жизнеспособным. До недавнего времени к категории недоношенных новорожденных относили всех детей, имевших при рождении массу тела менее 2500 г и длину менее 46 см. При этом гестационный возраст не учитывался. Однако выделение категории недоношенных детей только по антропометрическим характеристикам привело к тому, что около 30 % из них были младенцы, рожденные в срок, но имеющие задержку внутриутробного развития (small for date) (Г.М. Дементьева, Г.В. Яцык, 2004). Примерно в 8 % случаев вес детей, родившихся преждевременно, составляет более 2500 г. По данным Г.В. Яцык, в большинстве развитых стран недонашивание встречается в 3-10 % случаев, в России этот показатель составляет 6,2 % (А.А. Баранов с соавт., 2001). Исследования, проведенные на кафедре поликлинической педиатрии РМАПО М.В. Лещенко, показали, что среди детей, поступающих на воспитание в дома ребенка, недоношенные составляют 36,6-48,8 %. При этом высока доля глубоконедоношенных, число которых колеблется (в зависимости от региона) от 5,7 до 11,5 %. По принятой на сегодняшний день классификации (А.И. Хазанов) степень недоношенности определяют в соответствии с гестационным возрастом ребенка: I степень – 35–37 недель; II – 32–34; III – 29–31; IV – 28 и менее недель. Для характеристики преждевременно родившихся детей по массе тела условно выделяют четыре степени недоношенности: I степень – 2001–2500 г; II – 1501–2000 г; III – 1001–1500 г; IV – менее 1000 г. С клинических позиций для объективной характеристики ребенка целесообразно фиксировать и массу тела при рождении, и гестационный возраст ребенка. Параметры физического развития новорожденных в соответствии с гестационным возрастом представлены в табл. 1. Таблица 1 Основные параметры физического развития детей при рождении с учетом гестационного возраста (М±т)(по Г.М. Дементьевой, Е.В. Коротковой)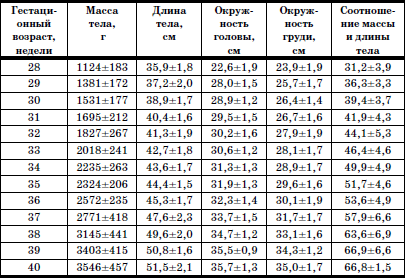 При снижении массы тела новорожденного на 2 и более стандартных отклонения или ниже 10-го центиля по сравнению с нормативными показателями для данного срока беременности диагносцируется задержка внутриутробного развития (ограничение развития – restriction). Различают следующие варианты задержки внутриутробного развития (ЗВУР): • гипопластический (симметричный), характеризующийся пропорциональным снижением как массы, так и длины тела ребенка при рождении; • гипотрофический (асимметричный), при котором отмечается дефицит массы тела по отношению к длине; диспластический, для которого характерны низкая масса и длина тела в сочетании с врожденными пороками развития и/или множественными стигмами дизэмбриогенеза. Выделение трех вариантов ЗВУР отражает период возникновения нарушений внутриутробного развития, связанных с воздействием повреждающих факторов. Так, при неблагоприятных воздействиях на ранних этапах внутриутробного развития отмечается пропорциональное уменьшение размеров органов и всего тела (симметричный тип). Гипотрофический (асимметричный) тип ЗВУР связывают с перераспределением кровотока к жизненно важным органам плода (мозг, сердце), формирующимся в условиях хронической гипоксии во второй половине беременности. Диспластический вариант ЗВУР связан с ранним и достаточно длительным воздействием неблагоприятных факторов, включающим период органогенеза во внутриутробном развитии. В целом около 80 % новорожденных с ЗВУР относятся к асимметричному типу, что тесным образом связано с патологическим течением беременности, в частности, с нарушением маточно-плацентарного кровообращения, артериальной гипертензией. Среди воспитанников домов ребенка, рожденных преждевременно, более чем в 53 % случаев отмечается диспластический вариант ЗВУР, что свидетельствует о длительном воздействии повреждающих факторов, нарушающих процессы закладки и дифференцировки тканей и органов. В соответствии с данными всероссийской диспансеризации 2002 г., у 21 % новорожденных выявляется задержка внутриутробного развития. Частота ЗВУР коррелирует со степенью недоношенности новорожденного: чем меньше гестационный возраст ребенка, тем чаще встречается ЗВУР. Среди недоношенных детей, воспитывающихся в домах ребенка, ЗВУР диагностируется более чем в 50 % случаев. Среди факторов, способствующих преждевременному рождению ребенка, выделяются социально-экономические и медико-биологические. Наиболее значимыми социальными факторами являются: отсутствие медицинского наблюдения и помощи беременной, дефицитное питание, неудовлетворительные бытовые условия, асоциальные формы поведения и вредные привычки беременной (употребление алкоголя, наркотиков, курение); профессиональные вредности, факт нежелательной беременности и беременность вне брака; юный (до 18 лет) либо пожилой (старше 30) возраст матери. К важным медико-биологическим причинам недонашивания относятся: отягощенный акушерско-гинекологический анамнез (наличие абортов, самопроизвольных выкидышей, короткий интервал между родами и др.), патологическое течение беременности (токсикозы, иммунологический конфликт между матерью и плодом, аномалии плаценты и др.), соматические заболевания матери, особенно с явными обострениями и декомпенсациями во время беременности. Со стороны плода причинами недонашивания являются внутриутробные инфекции, генетические заболевания. Обычно имеется сочетание и взаимодействие нескольких факторов. Наиболее значимыми факторами риска ЗВУР являются соматическая патология беременной, приводящая к нарушениям трофики плода (гипертоническая болезнь, заболевания почек и др.), хромосомные аномалии плода, внутриутробные инфекции (входящие в группу заболеваний TORCH и другие инфекции). Недоношенности и задержке внутриутробного развития принадлежит значительный вклад в развитие хронической патологии и детской инвалидности. Состояние здоровья недоношенных детей раннего и дошкольного возраста характеризуется худшими показателями, чем здоровье их доношенных сверстников. Изучение параметров физического развития детей раннего возраста, рожденных преждевременно (А.А. Баранов с со-авт.), показало, что 27 % детей с ЗВУР и 19,3 % недоношенных детей, соответствовавших гестационному возрасту при рождении, имеют низкий рост (среди доношенных – 10 %). Преобладают дети с дефицитом массы тела, которая отмечается в 43,2 % у детей с ЗВУР и в 21,7 %– у детей, соответствовавших гестационному возрасту. Гармоничное развитие в раннем возрасте имеют менее 45 % среди всех недоношенных. При этом у детей с ЗВУР чаще встречается негармоничное развитие за счет дефицита массы при нормальном росте и сочетанное снижение массы и длины тела. К дошкольному возрасту количество детей с нормальным физическим развитием уменьшается (41,6 %), в основном за счет увеличения численности детей с дефицитом массы тела и сочетанным снижением массы и длины тела. В дошкольном возрасте преобладает микросоматический соматотип (25 %). У воспитанников домов ребенка дошкольного возраста, родившихся недоношенными, микросоматической соматотип отмечается в 45–48 % случаев. По мнению профессора К. Л. Печоры, у детей, родившихся недоношенными, отмечается снижение уровня НПР. Особенно страдает речевое, сенсорное развитие, в дошкольном возрасте – мышление, внимание, память. Практически все дети, рожденные преждевременно и воспитывающиеся в домах ребенка, имеют задержки интеллектуального развития. Характерными психологическими качествами у них являются тревожность, трудности в общении, конфликтность, враждебность. Наиболее выражены эти признаки у детей с ЗВУР. Уровень общей заболеваемости у преждевременно рожденных детей раннего возраста выше, чем у доношенных сверстников. При этом у детей с ЗВУР он в 1,6 раза выше, чем у недоношенных, соответствовавших своему гестационному возрасту, и в 1,8 раза выше, чем у детей, рожденных в срок. В условиях дома ребенка уровень заболеваемости среди недоношенных более чем в 2 раза выше, чем у доношенных. В структуре заболеваемости в раннем возрасте главенствующее место занимает патология органов дыхания, в основном за счет острых респираторных инфекций. Для воспитанников домов ребенка характерны затяжные и осложненные формы заболевания, особенно у детей с ЗВУР. Второе и третье место принадлежат нарушениям со стороны нервной системы, болезням крови и кроветворных органов. Далее следуют патология пищеварительной системы и инфекционные заболевания. По литературным данным, среди недоношенных патология нервной системы в среднем диагностируется в 70,8 % случаев, в то время как среди воспитывающихся в домах ребенка эти нарушения отмечаются у 100 % детей. Исследования показали (D. Wiedrik), что наиболее неблагоприятным следствием недоношенности являются грубые нарушения со стороны нервной системы, приводящие к инвалидности (дезабильности) ребенка. По данным Ю.И. Барашнева, при обнаружении у досрочно родившихся детей неврологических нарушений легкой и средней степени тяжести инвалидность наступает в 28,5 и 60,6 % случаев соответственно. Тяжелые повреждения, перенесенные в перинатальном и неонатальном периодах и потребовавшие применения методов интенсивной терапии и реанимации, способствуют возникновению инвалидности в 97 % случаев. Наиболее частые причины инвалидности: детский церебральный паралич, слепота, глухота, задержка умственного развития тяжелой степени, гидроцефалия, эпилепсия. Чрезвычайно важным является тщательное динамическое наблюдение за ростом и развитием недоношенных детей с применением современных клинических и инструментальных методов и методик, позволяющих выявить тревожные признаки (Войта-диагностика, МРТ и др.). Это позволяет более результативно осуществлять профилактику формирования тяжелой инвалидности и раннюю реабилитацию детей, которым угрожает развитие инвалидности. Болезни крови и кроветворных органов в основном представлены ранней и поздней формами железодефицитной анемии, частота которой, по данным различных авторов, колеблется от 70 до 91,1 %. Для недоношенных детей характерна высокая частота врожденных аномалий развития, которая в 6-10 раз превышает таковую среди детей, рожденных в срок. В связи с этим необходимо подчеркнуть, что наследственная моногенная, полигенная и врожденная патология служит основанием для возникновения 90 % хронических заболеваний и является одной из главных причин детской инвалидности (Ю.Е. Вельтищев с соавт.). В связи с этим становится очевидной необходимость более тщательной диагностики пороков развития, включая стигмы дисэмбриогенеза. Состояние досрочно родившихся детей характеризуется распространенностью хронической патологии. Хронические заболевания в стадии компенсации и субкомпенсации имеют в целом около 43 % недоношенных в дошкольном возрасте и около 70 % детей – воспитанников домов ребенка. В связи с этим превентивная терапия и профилактика, лечение и реабилитация (абилитация) данной категории детей являются одним из серьезнейших направлений в работе медико-психолого-педагогического персонала домов ребенка. Недоношенные дети поступают в дома ребенка на III этапе реабилитации. Для адекватной оценки состояния детей и оказания эффективной помощи сотрудники домов ребенка должны быть знакомы с анатомо-физиологическими особенностями недоношенных, основными принципами и современными подходами к их реабилитации. 1. Анатомо-физиологические особенности недоношенных Телосложение недоношенных детей имеет характерные особенности: относительно большая голова, преобладание мозговой части черепа, открытые малый и боковой роднички, кости черепа податливы; слабое развитие подкожно-жировой клетчатки; низкое расположение пупочного кольца; мягкие ушные раковины, лагуно; при высокой степени недоношенности – недоразвитие ногтей; у мальчиков – яички не опущены в мошонку, у девочек – недоразвитие больших половых губ и гипертрофия клитора. Нервная система ребенка характеризуется быстрой истощаемостью физиологических рефлексов (при глубокой недоношенности отсутствуют сосательный и глотательный рефлексы). Реакция на внешние раздражители замедлена; характерны мышечная гипотония и склонность к судорожным проявлениям. Детям с низкой массой тела свойственны нарушения терморегуляции вследствие незрелости центральных механизмов регуляции теплообмена. Особенностью дыхания недоношенных является недостаточное развитие дыхательных мышц, податливость грудной клетки, ребра расположены перпендикулярно грудине. Верхние дыхательные пути узкие, диафрагма располагается относительно высоко. Дыхание поверхностное, частое (40–80 в минуту), объем дыхания по сравнению с доношенными детьми снижен. Характерны периодические апноэ. Недоношенные предрасположены к аспирации молоком в верхние дыхательные пути при кормлении. С этим связаны особенности ухода и вскармливания. У глубоко недоношенных детей дыхание приобретает регулярность только к 3–4 месяцам жизни. Сердечно-сосудистая система их характеризуется относительной незрелостью. Пульс лабильный, слабого наполнения, с частотой 120–160 ударов в минуту; в течение длительного времени может сохраняться открытый боталлов проток. По данным Г.М. Дементьевой, он обнаруживается у 20 % детей с гестационным возрастом 34–36 недель и более чем в 40 % случаев при гестационном возрасте меньше 34 недель. Объективные методы диагностики (ЭХО-кардиографическое, допплерографическое обследование) позволяют выявить открытый артериальный проток в 90-100 % случаев. Незрелость органов пищеварения проявляется малым объемом и вертикальным положением желудка, недостаточной секрецией и активностью пищеварительных ферментов, что предрасполагает к развитию функциональных нарушений со стороны кишечника. Относительное недоразвитие мышц кардиальной части желудка способствует регургитации и срыгиванию. Затруднение процессов переваривания приводит к развитию метеоризма и дисбактериоза. Кишечные стенки у недоношенных детей обладают высокой проницаемостью, что облегчает проникновение микробов и токсинов в кровь. Мочевыделительная система их отличается функциональной незрелостью, проявляющейся снижением клубочковой фильтрации и фильтрационной способности канальцев. Водно-солевой обмен лабилен, дети склонны как к образованию отеков, так и к быстрому обезвоживанию. Для первых дней жизни характерны высокие показатели остаточного азота в крови. Моча слабоконцентрированная, суточное количество составляет 3–4 мл на килограмм массы в час. Состояние эндокринной системы зависит от степени зрелости ребенка и наличия эндокринных нарушений у матери. Надпочечники недоношенного морфологически и функционально незрелы, что способствует их быстрой истощаемости при длительной стрессовой ситуации (инфекции, охлаждении и т. п.). Функциональная незрелость щитовидной железы определяет возможность развития транзиторного гипотиреоза. Особенностью кроветворной системы недоношенных детей является сохранение экстрамедуллярного кроветворения после рождения. Эритроциты содержат относительно высокое количество фетального гемоглобина. Так, в возрасте 6–9 недель его уровень у недоношенных составляет 77,3 % при 33,9 %– у доношенных детей. Эритроциты, содержащие такой гемоглобин, подвержены гемолизу. При этом не вполне зрелый костный мозг не в состоянии восполнить убыль разрушенных эритроцитов, что способствует развитию ранней анемии, в основе которой лежат повышенный гемолиз эритроцитов, быстрое (по сравнению с доношенными детьми) увеличение объема крови, функциональная незрелость костного мозга. Во втором полугодии жизни у недоношенных на фоне истощения эндогенных запасов железа может развиваться железодефицитная анемия. 2. Основные принципы реабилитации детей Морфофункциональные особенности недоношенных и маловесных детей, распространенность патологии центральной нервной системы, аномалий развития и внутриутробных инфекций лежат в основе высокой соматической заболеваемости, ранней хронизации болезней и формирования инвалидности. Повышение выживаемости преждевременно родившихся детей, особенно глубоко недоношенных, привело к росту числа детей, требующих постоянного комплексного медико-психолого-педагогического наблюдения и проведения реабилитационных мероприятий на всех этапах выживания. Профессором Г.В. Яцык были сформулированы основные принципы реабилитации детей: 1. Раннее начало реабилитации: вторая-третья неделя жизни (включая крайне маловесных недоношенных детей). 2. Строго индивидуальный подход к больному ребенку (в зависимости от возраста, степени зрелости, тяжести основной патологии и т. п.). 3. Подход с позиций целостного организма (нельзя заниматься только коррекцией неврологических нарушений). У большинства детей раннего возраста нарушения носят нейросоматический характер. У части детей в клинической картине преобладают соматические проявления перинатального поражения нервной системы (вегето-висцеральные нарушения). 4. Комплексное использование различных средств: медикаментозных, физических, психолого-педагогических. 5. Преемственность мер реабилитации на различных этапах оказания помощи. Этапность реабилитационных мероприятий предполагает последовательность в использовании различных приемов и способов коррекции, обеспечения процесса реабилитации в различных условиях. Дом ребенка является третьим этапом выхаживания недоношенных детей, оставшихся без попечения родителей. Здесь обеспечиваются не только медицинская, но и психологопедагогическая реабилитация ребенка, его социализация, подготовка к уходу в семью, под опеку и т. п. Перевод недоношенного из стационара в дом ребенка осуществляется при условии его хорошей адаптации: наличии самостоятельного сосания, синхронности между процессами сосания и глотания, положительной динамике массы тела, достаточной терморегуляции. Преемственность между стационаром и домом ребенка обеспечивается передачей подробной документации, содержащей анамнестические сведения о ребенке, его состоянии в неонатальный период, результаты обследования, проведенную терапию, рекомендации на ближайшие 1–3 месяца. Важным компонентом выхаживания недоношенных и маловесных детей является обеспечение гигиенических условий их содержания: создание оптимальной температуры (23–25 °C), и влажности в помещении (60–70 %), проведение регулярного (не менее 5 раз в сутки) проветривания, обеспечивающего эффективный воздухообмен и кислородный режим, и влажной уборки. Большую роль играет назначение правильного режима в соответствии со степенью недоношенности и состояния ребенка. Варианты режимов представлены в табл. 2. Таблица 2 Основные режимные элементы для недоношенных детей первого года жизни в зависимости от массы тела при рождении и возраста  Недоношенные и маловесные дети требуют особого внимания со стороны персонала дома ребенка как в период адаптации к дому ребенка, так и в ходе дальнейшего пребывания в группе. Это связано с их биологическими особенностями, предрасположенностью к развитию острой патологии, высоким риском возникновения жизнеугрожающих состояний (синдром внезапной смерти). Динамическое наблюдение за недоношенными детьми и детьми с ЗВУР осуществляется с учетом группы здоровья и группы риска, диагностированных у данного ребенка. Необходим регулярный контроль за динамикой массоростовых показателей и нервно-психическим развитием. При оценке результатов измерения параметров физического и нервно-психического развития важно учитывать степень недоношенности ребенка. С этих позиций наиболее значимой является выраженная положительная динамика развития ребенка, а не абсолютное значение результатов обследования. Для контроля за нервно-психическим развитием недоношенных традиционно в домах ребенка используют показатели НПР детей первого года жизни, разработанные в 1920–1930 годах XX в. проф. Н.М. Щеловановым, дополненные и переработанные Э.Л. Фрухт (кафедра поликлинической педиатрии РМАПО). Кроме того, для диагностики НПР может быть использована Денверская шкала, позволяющая учитывать степень недоношенности ребенка. Диспансерное наблюдение за такими детьми предусматривает систематический осмотр их специалистами. Кроме того, они должны быть подвергнуты аудиологическому скринингу на первом месяце жизни, поскольку недоношенность является фактором риска тугоухости. Нарушения слуха, связанные с повреждением слухового нерва, наблюдаются у 9 % детей, родившихся с массой тела менее 1500 г. В возрасте 4–6 недель недоношенные должны быть осмотрены офтальмологом. Детям с массой тела менее 1500 г при рождении, а также всем недоношенным, получавшим интенсивную терапию или искусственную вентиляцию легких, показано проведение непрямой бинокулярной офтальмоскопии для выявления признаков ретинопатии. Установлено, что при гестационном возрасте 34–35 недель она выявляется у 13,5 % детей; при сроке гестации менее 30 недель – в 41,9 % случаев. Учет результатов лабораторных и дополнительных инструментальных исследований, заключения и рекомендации специалистов позволяют выработать индивидуальный план лечения и реабилитации детей. В основе лечебной и реабилитационной работы лежит организация рационального и адекватного вскармливания недоношенного и маловесного ребенка. Несомненно, лучшим питанием для любого новорожденного является материнское молоко; для недоношенного это тем более значимо, поскольку молоко преждевременно родившей женщины соответствует нутритивным потребностям и функциональным возможностям ее младенца. Однако дети, поступающие на воспитание в интернатные учреждения, как правило, лишены грудного вскармливания уже с рождения. В этой ситуации единственной приемлемой альтернативой материнскому молоку являются специализированные смеси. Они отличаются по составу от стандартных адаптированных смесей, содержат больше белка (1,9–2,4 г/100 мл), что обусловлено повышенной потребностью в нем недоношенных. Особое значение имеет качество белка. В связи с этим в современных специализированных смесях преобладает сывороточная фракция. Смеси на основе белка сои не применяются, так как усвоение белков, углеводов и минеральных веществ из них незрелым ребенком затруднено. Для лучшего усвоения углеводного компонента в смеси введена декстринмальтоза. Содержание витаминов, минеральных веществ и микроэлементов повышено в соответствии с потребностями детей. Обязательными компонентами являются таурин и L-карнитин. Энергетическая ценность специальных смесей несколько выше обычных. Перевод ребенка на адаптированную молочную смесь проводится постепенно, по достижении им массы 2500 г. В небольшом объеме, при необходимости, специализированная смесь может сохраняться в питании на протяжении нескольких месяцев. Состав отдельных специализированных смесей представлен в табл.3. Таблица 3 Состав некоторых специализированных смесей для недоношенных детей (на 100 мл)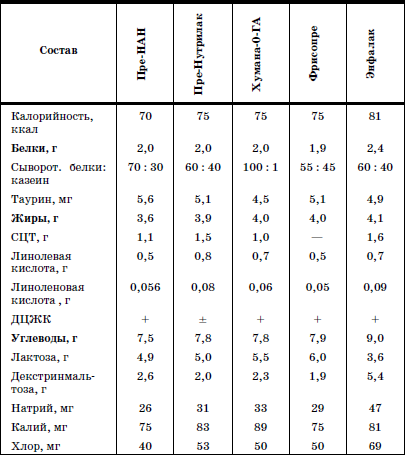 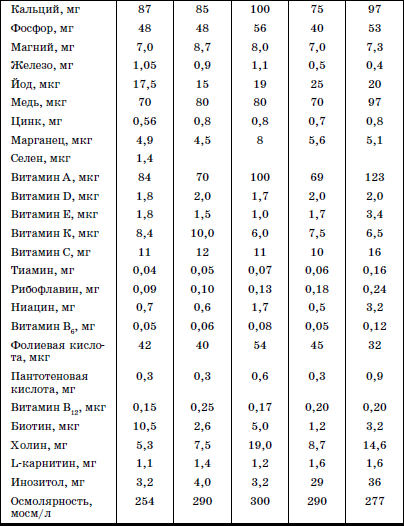 Прикорм недоношенным детям вводят в обычные сроки или на две недели раньше. Однако последовательность введения новых продуктов имеет свои особенности, связанные с характерными для них нарушениями со стороны желудочно-кишечного тракта. Первым целесообразно вводить фруктовое пюре (яблоко) без сахара промышленного производства. Затем, в случае хорошей переносимости, вводят соки. Каши могут назначаться раньше, чем овощные пюре, но не ранее 4-месячного возраста. Сначала вводятся безглютеновые и безмолочные каши. Они разводятся смесями, которыми вскармливается ребенок. При развитии железодефицитной анемии мясо в питание вводят с 5-6-месячного возраста. При вскармливании специализированными высокобелковыми молочными смесями творог вводится после 6 мес. Вскармливание недоношенного ребенка требует постоянного контроля его физического развития и расчета питания. Расчет питания проводится «энергетическим» методом с учетом калорийности используемой смеси. Энергетические потребности недоношенных детей в возрасте 10–14 дней составляют 100–120 ккал/кг/сут. и к 17-му дню возрастают до 130 ккал/ кг/сут., к концу месяца достигают 130–140 ккал/кг/сут. Начиная со второго месяца жизни ребенка, родившегося с массой тела более 1500 г, калорийность ежемесячно снижается на 5 ккал/кг до норм, принятых для недоношенных. Снижение калорийности питания детей с массой тела при рождении менее 1500 г проводится после 3-месячного возраста. 3. Реабилитация недоношенных детей с неврологической патологией Характерной особенностью здоровья недоношенных детей являются разнообразные проявления неврологической патологии. Схемы диагностических, лечебных и реабилитационных алгоритмов представлены в табл. 4–5. Таблица 4 Схема диагностических и лечебных алгоритмов при некоторых неврологических симптомах (Г.В. Яцык с соавт., 2002)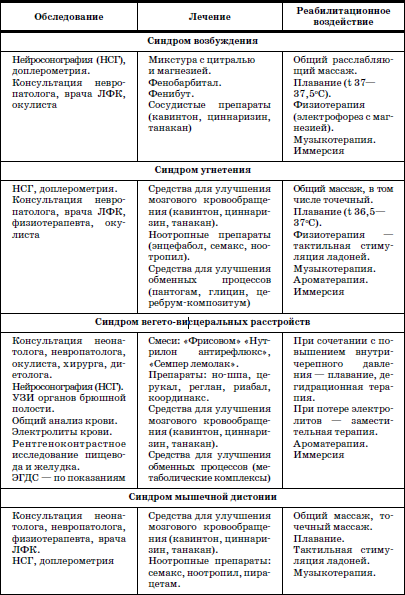 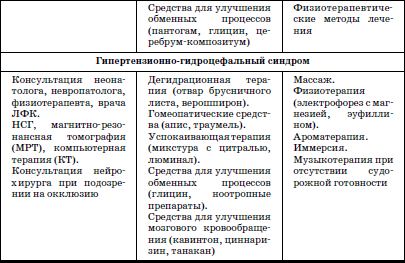 Показания к применению тактильного стимулирующего массажа кистей и пальцев рук (тонкий пальцевой тренинг) Показания к применению тактильного стимулирующего массажа кистей и пальцев рук (тонкий пальцевой тренинг)Детям до 1 месяца • Гипоксическое поражение ЦНС, синдром угнетения. • Недоношенность (в том числе гестационного возраста менее 32 недель). Таблица 5 Аминокислотно-витаминный метаболитный комплекс (глицин, биотридин, лимонтар)(По Г.В. Яцык с соавт.)  • Нарушение мышечного кровообращения. • Спинальные нарушения (ишемия) в шейном отделе (паретичные или патологические установки кистей). • Невозможность по тяжести состояния использовать общепринятые методы реабилитации. Детям 1 мес. – 1 год • Перинатальное поражение ЦНС. • Синдром мышечной дистонии. • Синдром вегето-висцеральных нарушений. • Задержка развития тонкой моторики. • Задержка речевого развития. Противопоказания • Судороги и судорожная готовность. • Острый период внутричерепного кровоизлияния (до 3 недель). • Состояния, сопровождающиеся интоксикацией. • Заболевания кожи.
ГЛАВА 2. Инфекции и специфические средства защиты (вакцинация) Типы иммунитета Иммунитет может быть врожденным (т. е. естественным). На него влияет пол ребенка: он более устойчив у девочек, так как их клетки содержат две X (икс) хромосомы, в отличие от мальчиков, а именно в Х-хромосомах содержатся иммунные гены. Однако при воздействии на организм неблагоприятных факторов (переохлаждение, гиповитаминоз, перегревание и др.) уровень естественного иммунитета существенно снижается. Приобретенный иммунитет формируется в процессе жизни ребенка. Он может возникнуть после перенесенного инфекционного заболевания и называться инфекционным иммунитетом, который сохраняется или пожизненно (после кори, ветряной оспы, полиомиелита), или кратковременно (острые кишечные инфекции, ОРВИ). Возможно формирование специфического иммунитета и через вакцинацию – это активный, поствакцинальный иммунитет, который сохраняется 5-10 лет (корь, дифтерия, столбняк, полиомиелит) и при своевременной вакцинации может держаться всю жизнь. Пассивный иммунитет создается при введении готовых антител в виде иммуноглобулинов, в состав которых входят IgG (80 %), IgM (10 %), IgA (10–15 %). Эти же антитела попадают в организм ребенка при переливании крови, плазмы, сыворотки, но сохраняются всего 3–6 месяцев. Разновидностью пассивного иммунитета является трансплацентарный иммунитет, осуществляемый путем передачи готовых антител от матери к плоду через плаценту, который также сохраняется 3–6 месяцев. Способность проникать через плаценту обладают только антитела класса IgG, поэтому младенцы первых месяцев жизни не восприимчивы к кори. IgG надежно защищает от коревого вируса, но совершенно не способен нейтрализовать возбудитель коклюша, который особенно тяжело протекает у детей этого возраста (смертельно тяжело). Это обусловлено тем, что антибактериальным действием обладает IgA, который через плаценту не проникает, и даже невысокий его уровень достигается только к 12–24 месяцам жизни. В связи с этим дети первого года чрезвычайно восприимчивы к бактериальной инфекции. Переход IgG через плаценту осуществляется в последние недели беременности, поэтому у недоношенных детей содержание IgG может быть низким или полностью отсутствовать. Собственный синтез IgG начинается только после рождения, уровня взрослого человека он достигает к 6–7 годам. Для секреторного IgA характерна локализация на слизистой дыхательных путей, пищеварительной системы, которые он защищает, а также в женском молоке. Синтез секреторного IgA при рождении ребенка отсутствует, нарастает очень медленно, и в раннем возрасте содержание его в 4–5 раз ниже, чем у взрослого человека. Этим можно объяснить особую восприимчивость новорожденных и детей первых месяцев и лет жизни к кишечным и респираторным (ОРВИ) заболеваниям. В условиях незрелости системного иммунитета важнейшим условием сохранения их здоровья является грудное молоко матери, содержащее большое количество секреторного IgA. Относительная иммунологическая незащищенность, отмечаемая до 1,5–3 лет, обусловливает повышенную восприимчивость к инфекциям детей этого возраста и их повышенную смертность. В повседневной практике прежде всего приходится иметь дело с проявлениями бактериальной инфекции. Это – дифтерия, коклюш, скарлатина, менингит, дизентерия, сальмонеллез и др. Следующая группа – вирусные инфекции (ОРВИ, корь, краснуха, паротит, полиомиелит, гепатиты, ВИЧ-инфекция и др.). 1. Профилактика инфекционных заболеваний в доме ребенка Профилактика инфекций базируется на соблюдении трех основных принципов. 1. Предупреждение заноса инфекции в коллектив. 2. Прерывание путей ее распространения. 3. Повышение невосприимчивости детей к инфекционным заболеваниям. Реализация первого принципа осуществляется через предварительное (в том числе лабораторное) обследование ребенка в условиях роддома, детской больницы, детской поликлиники с уведомлением об отсутствии контактов с инфекционными больными в последние 3 недели. С этой же целью каждый сотрудник при приеме на работу в дом ребенка проходит медицинский осмотр и лабораторное обследование. Кроме того, весь штат сотрудников должен быть вакцинирован против дифтерии, столбняка и подвергаться ревакцинации каждые 10 лет. Обязательны вакцинация против кори, полиомиелита, эпидемического паротита, краснухи, проверка на инфицированность туберкулезом с помощью пробы Манту. Второй принцип – предупреждение распространения инфекции в доме ребенка определяется рядом установок общего типа: • Правильное размещение групп в изолированных блоках, с отдельным входом, с необходимым набором помещений (раздевалка, игровая комната, столовая, спальня, горшечная, душевая); для временного содержания заболевшего ребенка должен быть изолятор. • Рациональная организация работы пищеблока. Исключаются из рациона продукты без термической обработки (творог, сметана, салаты). К работе на пищеблоке не допускаются лица с признаками инфицирования порезов, царапин, паранихиями, фурункулами, а также с симптомами вирусных, бактериальных и других инфекций и т. п. Исключительно важное значение имеет и внутригрупповая профилактика. Последняя во многом строится с учетом путей передачи инфекции. Так, при кишечной инфекции, при гепатите А лидирует орально-фекальный путь передачи, а также непосредственно от больного к здоровому или опосредованно – через руки персонала, одежду, постельные принадлежности, загрязненные предметы, игрушки и, особенно, через пищу и воду. Поэтому персоналу прививается культура мытья рук, проводится систематическая влажная уборка помещений и обработка предметов обихода дезинфицирующими растворами. Организация и проведение дезинфекционных мероприятийТекущая дезинфекция – в период нахождения больного в доме ребенка. Заключительная дезинфекция – при удалении больного. Последняя, как правило, проводится или контролируется специалистами службы дезинфекции. Профилактическая дезинфекция – выполняется постоянно персоналом дома ребенка. Положение, ответственность и должностные обязанности сотрудников, осуществляющих в учреждении дезинфекционную деятельность, должны быть разработаны в доме ребенка и согласованы с территориальным центром Госсанэпиднадзора. Для производственного контроля за этим процессом руководитель учреждения приказом назначает работника, ответственного за эту работу, который должен получить специальную подготовку на курсах специализации по дезинфекционному делу на базе территориального центра Госсанэпиднадзора. Для профилактической дезинфекции применяют наиболее доступные и безопасные для окружающих физические и химические средства, содержащие в своем составе катионные поверхностно-активные вещества (КПАВ). При уборке помещений применяют кальцинированную соду, синтетические моющие средства (CMC). Столы для белья должны иметь гладкую поверхность и протираться дезинфицирующими препаратами после каждого ребенка. Предметы, которые дети часто берут в рот, также подвергаются обеззараживанию. Мягкие игрушки следует закреплять за конкретными детьми. Парентеральный (внутривенный, внутримышечный) путь передачи инфекции у детей имеет место при гепатите В, гепатите С, ВИЧ-инфекции. При этом важно знать, что носители вирусов гепатита В и С не представляют опасности для окружающих. Однако если ребенок, носитель вируса гепатита В или С, получил травму, сопровождающуюся кровотечением, необходимо незамедлительно убрать кровь, обработать загрязненные предметы дезинфицирующими средствами и все манипуляции проводить в перчатках. Такие дети должны иметь индивидуальную посуду и игрушки. Для предупреждения распространения заболеваний, передающихся воздушно-капельным путем, решающее значение имеет незамедлительная изоляция заболевшего. Во многом профессиональная грамотность как медицинского, так и педагогического персонала дома ребенка, способного самостоятельно, в любое время суток, выявить заболевшего, изолировать его, постоянно соблюдать все необходимые меры по санитарно-противоэпидемическому режиму, – основа предупреждения распространения инфекции в группах. Сигналом о начале заболевания служат прежде всего изменения в поведении ребенка, нарушение аппетита, цвета кожных покровов, появление сыпи, кашля, насморка и т. д. Все это должно быть предметом пристального внимания каждого, кто ухаживает за ребенком. В этом плане большую роль играет не только внешний осмотр, но и осмотр зева, слизистой рта. Тщательный ежедневный медицинский осмотр и постоянное наблюдение за поведением детей со стороны ухаживающего персонала – основа ранней диагностики инфекционного процесса. Третий принцип, обеспечивающий предупреждение инфекционных заболеваний в доме ребенка, – повышение невосприимчивости детей к этим заболеваниям. Здесь решающая роль принадлежит вакцинопрофилактике. 2. Вакцинопрофилактика Установлено, что только массовая вакцинация, охватывающая не менее 95 % населения, особенно детского возраста, обеспечивает надежный заслон развитию эпидемий, и прежде всего у детей первых двух лет жизни. Следует сказать, что отступление от этого правила является одной из главных причин развития эпидемий. Так, эпидемии дифтерии, пик которой пришелся на 1994 г., предшествовало падение вакцинированности населения до 67 %, причем особенно резко выраженное у взрослых, поэтому последние составили почти 80 % заболевших и умерших, а общее число потерь в Российской Федерации превысило 4000 человек. Ликвидировать эпидемию удалось только благодаря росту вакцинированности до 95 %, прежде всего – детского населения. Однако спорадические случаи этого заболевания, преимущественно у взрослых, сохраняются, поэтому недопустимо снижать уровень привитости детей. В настоящее время Федеральным законом «Об иммунопрофилактике инфекционных болезней» (1998) расширен национальный календарь обязательных профилактических прививок за счет вакцинации против гепатита В и краснухи. В окончательном варианте он утвержден в 2002 г. (табл. 6). При эпидемическом неблагополучии возможна дополнительная вакцинация против других инфекций (менингит, клещевой энцефалит, брюшной тиф, холера, сибирская язва и др.). Таблица 6 Национальный календарь профилактических прививок, 2002 г.1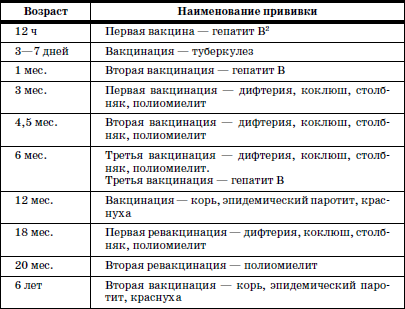 Характеристика вакцинальных препаратов Первый тип включает цельные убитые микроорганизмы (бактериальные вакцины). Это коклюшная, брюшнотифозная, холерная вакцины, а также – инактивированные вирусные вакцины (полиомиелитная вакцина Солка – ИПВ). Второй тип содержит инактивированные токсины (анатоксины), которые используются в профилактике тех заболеваний, где тяжесть процесса определяется токсинами, выделяемыми бактериями, почему и необходимо формирование антител, направленных против этих субстанций. Классическим примером является ассоциированная (комплексная) вакцина АДС, содержащая анатоксины дифтерии и столбняка. Третий тип – вакцины, состоящие из живых, аттенуированных вирусов: коревая (ЖКВ), паротитная (ЖПВ), полиомиелитная (ОПВ – оральная полиомиелитная вакцина) и др. Четвертый тип – БЦЖ – вакцина из микроба, вызывающего туберкулез рогатого скота, но при введении человеку возникает легкая инфекция с активной выработкой противотуберкулезных антител. Пятый тип – генно-инженерные, рекомбинантные, субъединичные и другие вакцины, созданные с использованием новейших биотехнологий. Это вакцины против гепатита В, гриппа и др. Шестой тип – ассоциированные вакцины, в состав которых входит несколько моновакцин, например, АКДС – ассоциированная коклюшно-дифтерийно-столбнячная вакцина. Место введения вакциныВнутримышечное введение дает наименьшую местную реакцию (АКДС), вакцина против гепатита В). До 18 месяцев используется переднебоковая часть бедра (в ягодичную область, где имеет место скопление жировой клетчатки и возможно повреждение сосудов, седалищного нерва, – нежелательно), у более старших – верхняя часть плеча (дельтовидная мышца). Подкожное введение обычно осуществляется в подлопаточную область (живые вакцины – коревая, краснушная, паротитная и др.). Внутрикожно строго вводится вакцина БЦЖ в область наружной поверхности плеча. Наконец, живая полиомиелитная вакцина (ОПВ) применяется перорально. Степень накопления защитных антител после введения вакцины у разных детей различна: от максимальной (титр 1:640-1280) до минимальной (1:80-1:40), а титр 1:20 свидетельствует об их отсутствии (серонегативный вариант). Прививки проводятся медицинским персоналом в учреждении, имеющем лицензию на этот вид деятельности. Вакцинацию лучше проводить натощак в утренние часы, в положении лежа или сидя, и в течение 30 мин должно быть обеспечено постоянное наблюдение. Сообщения о появлении побочных реакций необходимо направлять в адрес ГИСК им. А.А. Тарасевича: 119002, Москва, пер. Сивцев Вражек, д. 4, тел. (495) 241-3922. 3. Поствакцинальные реакции и осложнения Поствакцинальные реакции характеризуются кратковременным и цикличным течением и обычно не вызывают серьезных длительных расстройств. В состоянии ребенка в условиях массовой вакцинации неизбежно совпадение начала многих заболеваний с поствакцинальным периодом, что диктует необходимость проведения дифференциальной диагностики. В противном случае ошибочная трактовка их как поствакцинальных реакций и осложнений ведет к неверной терапии, что неизбежно ухудшает их прогноз. При решении этих вопросов следует использовать определенные ориентиры. Сроки появления поствакцинальных реакций При вакцинах II типа (анатоксин дифтерии, столбняка) реакции возникают максимально в течение 2 суток после введения. При коревой, краснушной, паротитной – в сроки 4-14 дней, при живой полиомиелитной вакцине (ОПВ) они удлиняются до 30 дней, а у контактных – и до 60 дней. Характерные клинические симптомы На вакцину АКДС у большинства детей реакции не наблюдается. У некоторых в первые 1–2 дня отмечаются повышение температуры (37,7-39 °C), беспокойство, нарушение сна, снижение аппетита, изредка рвота и местная реакция в виде гиперемии и отечности. Подобные реакции обычно заканчиваются благоприятно. У детей с аллергией может появляться сыпь, которая при этом чаще провоцируется пищевыми погрешностями. Вакцинация ОПВ – оральной полиомиелитной вакциной не вызывает ни общей, ни местной реакции. Исключительно редко (1:1,5 млн) развивается вакциноассоциированный полиомиелит. Паротитная иммунизация, как правило, протекает бессимптомно, и только у отдельных детей повышается температура, а в редких случаях – возникает незначительное увеличение околоушных желез. Коревая вакцина у большинства детей не сопровождается никакими клиническими реакциями, но у 5-15 % детей (по данным В.Ф. Учайкина) в период 4-14 дней появляются специфические признаки легкой коревой инфекции: повышение температуры (37,5-38 °C), катаральные явления (кашель, незначительный конъюнктивит, ринит), не обильная бледно-розовая сыпь в течение 2–3 дней. Необходимые мероприятия при выраженных поствакцинальных реакциях При температуре 38,5-39 С целесообразно назначение жаропонижающих средств (парацетамол, панадол, тайленол), при кожных аллергических проявлениях – антигистаминные препараты (пипольфен, дипразин, тавегил, супрастин). Витаминизированное обильное питье. Все эти сведения заносятся в историю развития за подписью врача. Поствацинальные осложнения встречаются редко. Симптомами вакцинального осложнения на АКДС являются: гипертермия (t 40 °C и выше), обширные местные реакции в виде резкой гиперемии и отека на месте введения. Со стороны центральной нервной системы – пронзительный крик, иногда судороги (связываются с повышением внутричерепного давления), остановка взора. По данным В.Ф. Учайкина, подобные осложнения встречаются с частотой 1:250 тыс. – 500 тыс. доз. В этих условиях обязательно назначение жаропонижающих средств (парацетамола), анальгина и пипольфена внутримышечно, физическое охлаждение. При судорожном синдроме со стойким нарушением сознания, при наличии гипертензионно-гидроцефального синдрома внутримышечно вводятся лазикс, преднизолон, седуксен (реланиум, диазепам). Появление бронхиальной обструкции, крупа чаще всего определяется наслоением на вакцинальный процесс острой респираторно-вирусной инфекции. Для устранения обструкции – пипольфен, спазмолитики (но-шпа, папаверин), возможно – нейролептики (аминазин, дроперидол), при нарастании симптомов – преднизолон. Исключительно редким осложнением аллергического характера являются отек Квинке и анафилактический шок. Отек Квинке Кожа в зоне отека белого цвета, плотной консистенции. В отдельных редких случаях отек Квинке может осложняться отеком гортани, при этом появляются охриплость голоса, лающий кашель, дыхание делается шумным, затрудненным. Неотложная помощь при отеке Квинке: внутримышечно вводить антигистаминные препараты, при нарастании тяжести – преднизолон. При распространении отека на гортань – дополнительно ввести адреналин подкожно, антигистаминные средства и преднизолон внутривенно, быть готовым к интубации трахеи и срочной госпитализации. Анафилактический шок Наибольшую опасность представляют его тяжелые формы, которые характеризуются молниеносным развитием с падением артериального давления, потерей сознания. У грудных детей его эквивалентом может быть коллаптоидное состояние (резкая бледность, цианоз, вялость, адинамия, падение артериального давления, холодный липкий пот, иногда потеря сознания). Развивается крайне редко, когда не учтены легко протекающие реакции предыдущих вакцинаций и отсутствует их коррекция. Необходимо немедленно прекратить введение вакцины, обеспечить проходимость дыхательных путей, при невозможности – интубация. Одновременно придать ногам более высокое положение, ингаляция кислорода, адреналин подкожно, внутривенное введение жидкости (полиглюкин, реополиглюкин) из расчета 10 мг/кг (для восстановления объема циркулирующей крови), введение внутривенно преднизолона, дипразина, медленно – эуфиллина и после стабилизации состояния – транспортировка в стационар. При развитии поствакцинального осложнения необходимо незамедлительно поставить в известность районные службы санэпиднадзора, а также направить необходимые сведения в ГИСК им. А.А. Тарасе-вича. При диагностике поствакцинальных осложнений следует учитывать их специфику, а также сроки появления. Так, развитие артралгии, артрита возможно только при краснушной вакцине, менингиальные симптомы – при паротитной, ме-нингококковой, а энцефалопатии – реакция на введение АКДС, ЖКВ (живая коревая вакцина). Здесь уместно сравнить (табл. 7) частоту энцефалопатии у детей при заболевании корью и при введении живой коревой вакцины (данные М.П. Костинова). Таблица 7 Частота развития осложнений при заболевании корью и введении живой коревой вакцины (ЖКВ)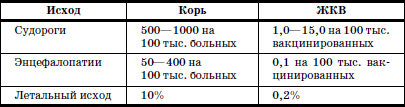 Таблица 8 Перечень медицинских противопоказаний к проведению профилактических прививок1Приложение 4 к приказу Министерства здравоохранения Российской Федерации от 18.12.97 № 375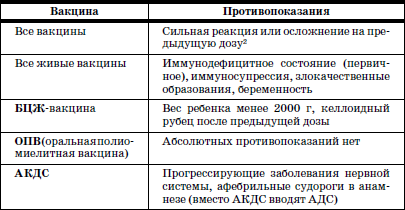 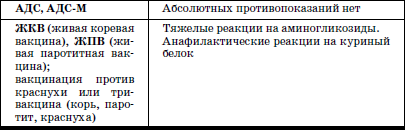
Таблица 9 Ложные противопоказания к проведению прививок Аллергия в прежние годы была наиболее частым поводом для отвода от прививок, особенно АКДС. Эпидемия дифтерии 1994 г., которая унесла более 4 тыс. жизней, еще раз показала, что при аллергии введение больным специфической сыворотки как единственного средства спасения смертельно опасно, поскольку лошадиная сыворотка – это чужеродный белок, способный вызвать при аллергии шок. Вот почему подобные противопоказания были пересмотрены. Вместе с тем при аллергических состояниях у детей необходимо проводить вакцинацию в спокойный период, на фоне гипоаллергической диеты, с предварительным введением антигистаминных препаратов, иногда – жаропонижающих средств. При обструктивных проявлениях в анамнезе на фоне вышеуказанных назначений дополнительно вводится спазмолитик (эуфиллин, теофиллин). Вакцинация детей при поражении центральной нервной системы (ЦНС) Многолетние исследования НИИ детских инфекций МЗ РФ (С.-Петербург), посвященные этой проблеме, показали целесообразность и эффективность вакцинации этих детей. Вместе с тем существует определенное негативное отношение к введению АКДС из-за отрицательного влияния коклюшного компонента. Однако освобождение детей от вакцинации приводит к риску инфицирования коклюшем, который особенно тяжело, нередко со смертельным исходом, протекает у детей первого года жизни. Исследованиями М.П. Костинова с соавторами установлено, что вакцинацию АКДС при гипертензионно-гидроцефальном синдроме можно начинать на фоне клинической компенсации. Дети при этом синдроме, как правило, получают длительные курсы дегидратационной терапии (диакарб, глицерол, фитотерапия, гомеопатические средства и т. п.), которая может расцениваться как основная подготовка для проведения прививки. Если у ребенка предполагается склонность к судорожным состояниям, целесообразно до и после введения АКДС включить противосудорожные средства. При выявлении прогрессирующей гидроцефалии коклюшная вакцина не вводится и АКДС заменяется АДС или АДС-М. Иммунизация осуществляется в состоянии компенсации с применением средств дегидратации. Итак, предусмотреть все возможные варианты заболеваний нервной системы и тактику вакцинации детей с такой патологией достаточно сложно. Целесообразно следовать принципу – для детей с поражениями нервной системы гораздо опаснее инфекция, чем возможные побочные эффекты вакцинации[1]. 4. Характеристика отдельных бактериальных и вирусных инфекций у детей ДифтерияБлагодаря всеобщей вакцинации процент иммунизированных детей практически доведен до 95 %, и на 40 территориях Российской Федерации дифтерия уже не регистрируется. Однако бдительность не должна быть утрачена, так как для этой инфекции характерно бактерионосительство у здоровых людей, особенно при патологии в носоглотке, поэтому надеяться на полное ее искоренение в мире, как это произошло с натуральной оспой в 1980 г., не приходится. В связи с этим возможность дифтерии в детском коллективе не исключается, значит, сохраняется настоятельная необходимость всеобщей вакцинации. Особенно следует считаться с тем обстоятельством, что в последнее время в Москве ежегодно число заболевших дифтерией держится на уровне 80-100 человек, причем 2/3 из них – это непривитые взрослые. Поэтому необходимо чрезвычайно внимательно относиться к начальным признакам заболевания, когда токсины бактерий еще не успели проникнуть в наиболее уязвимые системы организма – сердце, почки и нервную систему. Последнее, как правило, происходит спустя три дня с начала заболевания, и тогда летальность от токсических форм дифтерии достигает 70 %. Вот почему повышение температуры, рвота, ангина, осиплость голоса, грубый лающий голос, особенно затрудненное дыхание и отек в области шеи (подчелюстной клетчатки) – крайне тревожный сигнал для каждого взрослого человека, ухаживающего за ребенком. К сожалению, анализ эпидемии 1994 г. свидетельствует об отсутствии необходимой бдительности у врачей и среднего медицинского персонала, поэтому только 19 % детей было госпитализировано в первые 3 дня болезни, а 52 %– после 7-го дня. Инфекция при дифтерии распространяется воздушно-капельным путем, контактным, пищевым, а также, будучи устойчивой во внешней среде, – через игрушки и предметы ухода, что диктует необходимость соответствующей обработки этих предметов. Карантин накладывается на 7 дней на всех контактных в группе. Дети подвергаются ежедневному медосмотру, у них берется мазок из носа и миндалин на возбудителя дифтерии. КоклюшСитуация с заболеваемостью коклюшем остается неустойчивой. Так, в Москве она имеет волнообразное течение, с колебаниями от 850 до 4200 случаев за год, последний подъем имел место в 2003 г. Данное положение во многом связано с тем, что достигнуть 95 % вакцинации у детей к 2 годам не удается из-за известной реактогенности коклюшной цель-ноклеточной вакцины. Однако, с точки зрения академика В.Ф. Учайкина, эта опасность сильно преувеличена, особенно для этапа вакцинации (3–4, 5–6 месяцев). Что касается ревакцинации в 18 месяцев, то здесь оптимальное решение, особенно для детей с поствакцинальными реакциями в первом полугодии, – использование бесклеточной (абациллярной) коклюшной вакцины. Кстати, в настоящее время, в частности в США, обсуждается вопрос о введении второй ревакцинации в 4–6 лет, но только бесклеточной вакциной, чтобы обеспечить сохранение иммунитета и во взрослом состоянии. Тем более, что именно старшие дети и взрослые нередко являются источниками коклюшной инфекции. МенингитЭто грозное инфекционное заболевание часто вызывается менингококком (40–55 %), а также гемофилюс инфлюэнция (35–40), пневмококком (3–5), 1–2%– другими возбудителями (стрептококк, сальмонеллы, листерии – преимущественно у новорожденных). Менингококковая инфекция (по прежней терминологии – цереброспинальный менингит) развивается чаще у детей от 2 месяцев до 4 лет, чему способствует повышенная проницаемость гемато-энцефалического барьера в этом возрасте, а также недоношенность, искусственное вскармливание, другие заболевания. Для данной инфекции в Российской Федерации характерны эпидемические подъемы заболеваемости примерно каждые 20–30 лет. В межэпидемический период, когда частота заболеваемости не превышает 1–2:100 тыс. населения, болеют преимущественно дети первых лет жизни; но при ее подъеме возможно поражение и других возрастов, в том числе и взрослых. В ряде территорий, включая и Москву, заболеваемость повышена (2,71-3,93/100 тыс.), что свидетельствует о явном эпидемическом подъеме. В соответствии с этой обстановкой «организованное детство» особо восприимчивого возраста (от 1,5 до 8 лет) в 2003–2004 гг. подвергалось иммунизации (использованы отечественная вакцина менингококковой группы А и французская Менинго А + С). Менингококковые вакцины слабореактивны, осложнения не описаны, противопоказаний нет, за исключением злокачественных новообразований, гемобластозов, острого периода инфекционных заболеваний. Подобная вакцинация проводится только по эпидемиологическим показаниям раз в три года и не включается в обязательный календарь прививок. При нарастании заболеваемости, особенно при ее уровне 20/100 тыс., прививками должно быть охвачено не менее 85 % всего населения. Гемофилюс инфлюэнцияИнфекция (haemophilus influenzae) впервые выделена в 1892 г. Р. Пфейффером. Долгое время микроб ошибочно считался возбудителем гриппа и поэтому получил название h. Influenzae. Этот микроб относится к условно-патогенным, которые у детей раннего возраста, особенно на фоне современной широкомасштабной антибиотикотерапии (подавляется конкурирующая, патогенная микрофлора), способны вызывать даже эпидемические вспышки. Данная инфекция является причиной развития не только менингита, но и пневмонии, бронхита, отита, эпиглотита, особенно у детей первых двух лет жизни; характеризуется тяжелым течением и слабой чувствительностью к антибиотикотерапии. В связи с этим во многих странах (США, Великобритания, ФРГ, Финляндия) проводится поголовная трехкратная вакцинация детей после 2–3 месяцев, что вызывает отчетливое снижение вышеперечисленных заболеваний. В настоящее время вносится предложение вводить моновакцину в 3–5 и 12 месяцев. У нас разрешена к применению моновакцина Act-Hib производства фирмы «Пастер-Мерье» (Франция). Вакцина отличается слабой реактогенностью и противопоказаний практически не имеет. Напряженный иммунитет формируется у 95 % детей продолжительностью 5 и более лет. 5. «Управляемые» вирусные инфекции у детей. Диагностика. Диспансеризация Это вирусные инфекции, при которых отсутствуют вирусоно-сительство, природный резервуар, промежуточный хозяин, а источником является только больной человек. При определенных условиях и доступных вакцинах человечество способно освободиться от этих заболеваний, как в свое время и от натуральной оспы. ПолиомиелитВозможность ликвидации этого смертельно опасного заболевания доказана уже во второй половине XX в., когда была получена живая орально-полиомиелитная вакцина (ОПВ) Сэбина и «убитая» (инактивированная) ИПВ Солка. Благодаря этим вакцинам страны Западного полушария, Тихоокеанского региона ликвидировали полиомиелит, вызванный «диким» штаммом вируса. В Российской Федерации в 1995–1996 гг. имела место вспышка полиомиелита (заболели 153 ребенка), но благодаря проведению туровой поголовной вакцинации детей первых трех лет жизни (национальные дни вакцинации – НДВ) с 1997 г. не зафиксировано ни одного случая полиомиелита. Таким образом, фактически к 2000 г. в 58 странах ликвидирован полиомиелит. Однако очаги «дикого» вируса полиомиелита еще сохраняются в ряде стран Африки, Азии, почему и невозможна отмена вакцинации полиомиелита. К тому же есть опасность появления вакцинального полиомиелита у непривитых детей, так как «живая» вакцина частично, выделяясь из кишечника, поражает окружающих, не имеющих иммунитета, способна вызвать развитие вялых параличей. Кстати, по проведению НДВ только Московский регион давал ежегодно 6–7 случаев вакцинального полиомиелита у непривитых детей. В настоящее время они не регистрируются. Вместе с тем следует знать о способности вакцинального вируса длительно циркулировать среди непривитых людей, восстанавливая при этом «дикие» свойства. Следовательно, крайне необходима поголовная вакцинация и осторожное обращение с вирусной вакциной. При наличии абсолютных противопоказаний к введению «живой» вакцины целесообразно воспользоваться инактивированной (ИПВ). Ликвидация полиомиелита в нашей стране обнажила необходимость повышенного внимания к острым вялым параличам у детей. Хотя основной причиной их развития является полиомиелит, параличи у детей могут возникать при острой инфекционной миэлопатии, инфекционной полинейропатии. К примеру, в Москве ежегодно регистрируется 13–18 таких случаев. Хотя эти параличи, в отличие от полиомиелита, заканчиваются относительно благоприятно и чаще всего полным выздоровлением, под их маской не исключается возможность проникновения и «дикого» вируса полиомиелита. Вот почему при каждом случае острого вялого паралича тщательному и прежде всего – срочному вирусологическому исследованию подвергаются выделения кишечника в первые дни заболевания. Подтверждением диагноза острого вялого паралича служат отсутствие «дикого» вируса полиомиелита, привитость детей, отсутствие температуры, менингеальных симптомов и др. При выявлении острого вялого паралича необходимо немедленно сообщить об этом в центр государственного эпидемиологического надзора и незамедлительно организовать всестороннее обследование. КорьЭто инфекционное вирусное заболевание в прежние времена, при отсутствии антибиотиков и вакцин, приводило к летальности в 25–40 % случаев, что в условиях 100 % восприимчивости определяло поголовную заболеваемость и гибель значительной части заболевших детей. Не случайно корь называли «детской чумой». Использование антибиотиков снизило летальные исходы от осложнений (пневмония и др.), однако угроза жизни и здоровью детей сохранялась. Только создание живой коревой вакцины (ЖКВ) позволило радикально повлиять на заболеваемость детей корью. Вакцина – отечественная, высокого качества. Ее отличительная особенность – температурная нестабильность, поэтому должны неукоснительно соблюдаться требования «холодовой цепи», когда на всех этапах ее следования (от производителя до ребенка) она должна содержаться в среде при температуре от +2 до +4 °C. В противном случае разрушаются иммуногенные свойства вакцины и она не обеспечивает должный защитный эффект. Следует учитывать и другие моменты. Например, ЖКВ можно вводить только через 3 месяца после переливания крови или ее препаратов, так как они содержат противокоревые антитела, которые циркулируют до 3 месяцев и способны разрушить антигены живой коревой вакцины. ЖКВ обычно не вводится и детям первого года, так как до 3 месяцев сохраняется материнский (трансплацентарный) иммунитет, а в последующие месяцы у ребенка еще снижена способность к созданию стойкого противокоревого иммунитета. Поэтому иммунизация ЖКВ проводится, как правило, в годовалом возрасте. Однако следует знать, что дети первого года, особенно второго полугодия, восприимчивы к кори, поэтому при наличии коревого контакта они должны быть обеспечены гамма-глобулином, т. е. пассивным иммунитетом, срок действия которого 3 месяца. Следует учесть, что процент повторно вакцинированных в 6 лет оказывается нередко сниженным (до 80–90 %), в связи с чем во взрослом состоянии всегда имеется часть людей, лишенных противокоревого иммунитета, причем эта группа нередко выступает в качестве источника коревой инфекции. При введении ЖКВ противокоревые антитела «накапливаются» уже через 10–14 дней. Вот почему непривитые дети старше года в первые 3 дня контакта могут получить противокоревую вакцину и к моменту развития заболевания (инкубационный период кори 9-14-21 день) будут защищены достаточным числом противокоревых антител. Благодаря всеобщей вакцинации ряд стран уже полностью освободились от кори и получили от ВОЗ сертификат «территории, свободной от кори». Поэтому комиссия ВОЗ в 1998 г. приняла решение о возможности элиминации кори к 2007 г., для чего необходимо главное условие: до 2 и до 7 лет должно быть вакцинировано не менее 95 % детского населения. В противном случае даже при вакцинации 90 % возможны эпидемические вспышки через 4–5 лет при появлении высоковирулентного вируса, дефектах «холодовой цепи», при заболеваемости детей до года и взрослых. Последние в настоящее время составляют 32 % заболевших. В Российской Федерации до 1993 г. было вакцинировано всего 82,6 % детей до 2 лет и заболеваемость составила 107,3/100 тыс. населения. За последние 10 лет процент вакцинированных детей этого возраста вырос до 95 % и произошло масштабное снижение заболеваемости, которая достигла самого низкого уровня в 2002 г. (всего заболело 578 человек – 0,39/100 тыс.), т. е. произошло ее многократное снижение. Однако в 2003 г. имел место некоторый подъем заболеваемости (3315 человек). Основные причины тому: 1) неизвестный прививочный анамнез (46,7 %); 2) отсутствие ревакцинации в 6 лет (19 %); 3) нарушение «холодовой цепи» (9,6 %) и пр. В связи с этим принимаются следующие меры: 1) в очагах, при контактах, проводится вакцинация всех непривитых лиц и лиц с неизвестным анамнезом; 2) однократно привитые должны получить ревакцинацию, в том числе взрослые до 35 лет. Эти решения отражены в программе Российской Федерации 2004 г. по элиминации кори в стране. Реальность программы подтверждается отсутствием кори в 33 территориях России. Важный принцип элиминации кори – лабораторное (в том числе и вирусологическое) обследование каждого ребенка с подозрительными экзантемами (высыпаниями), тем более что корь у привитых (при слабости вакцины – митигированная корь) имеет сходство с краснухой. КраснухаПроблемы с этой инфекцией в наших условиях обострились в последнее десятилетие, когда стало расширяться домашнее воспитание дошкольников, почему стал снижаться удельный вес постинфекционного иммунитета от контактов в организованных коллективах сбольными детьми. Соответственно с этим происходит нарастание числа серонегативных женщин детородного возраста, которое по Москве уже составляет 30–40 %. В связи с этим совершенно реальна угроза заражения краснухой беременной женщины, что порождает возможность формирования синдрома внутриутробной краснухи (СВК). Он проявляется недоношенностью, развитием ранних аномалий (врожденные пороки внутренних органов), энцефалитов и другими признаками внутриутробного инфицирования. Есть сведения, что в 16 % случаев у детей развитие энцефалита связано с вирусом краснухи. Особую опасность представляет инфицирование в первую неделю беременности, когда развитие СВК достигает 80 %. На 2-4-й неделе эта цифра снижается до 60 %, к 8 неделям – до 30, к 12 – до 8 %. В настоящее время накапливаются сведения, что краснушный синдром определенным образом влияет на формирование в старшем возрасте сахарного диабета, тромбоцитопенической пурпуры. Исходя из сказанного понятно, почему с 1997 г. вакцинация против краснухи была включена в российский национальный календарь обязательных прививок. К сожалению, у нас долгое время отсутствовала отечественная вакцина, поэтому приобретение вакцины за рубежом осуществлялось за валюту. Но в соответствии с федеральной целевой программой 1998 г. «Об иммунопрофилактике инфекционных болезней» предусмотрено производство почти 9 млн доз отечественной моновакцины. Используются зарубежные моновакцины – рудивакс («Авентис Пастер», Франция), эрвевакс («Смит Кляйн Бигем», Бельгия). Как известно, они вводятся в годовалом возрасте одномоментно с коревой вакциной («два укола – один крик»), что, естественно, порождает стремление воспользоваться ассоциированной (комплексной) вакциной корь-краснуха. Отечественный вариант пока отсутствует, поэтому приходится применять зарубежные ассоциированные вакцины с дополнительным включением еще и вакцины против паротита. Это MMR-II («Мерк Шарп Доум», Нидерланды), приорикс (Бельгия). Эпидемический паротит (паротитная инфекция)Характеризуется преимущественным поражением слюнных желез, реже других железистых органов и нервной системы. Так, поражение яичек и развитие орхита наблюдается у мальчиков от 10,9 до 33,7 % случаев (В.А. Постовит). Паротитный панкреатит, по данным литературы, выявляется также достаточно часто. Поражение нервной системы проявляется серозным менингитом (от 4 до 28 % заболевших), хотя не исключается и возможность развития менингоэнцефалита. Все это, а также высокая восприимчивость детей к данной инфекции (85 %) превращают эпидемический паротит в достаточно грозное заболевание. Катаральные явления обычно отсутствуют, поэтому передача инфекции осуществляется преимущественно капельным путем и совершается при коротких расстояниях контакта (до 1–2 м), т. е. при пользовании общими предметами и игрушками, инфицированными слюной больного. Наибольшая заболеваемость отмечается от 3 до 6 лет (дети первого года болеют редко). В связи с широкой активной иммунизацией с 1980 г. годовалых детей заболеваемость до 10 лет резко снизилась, и на этом фоне увеличивается удельный вес больных старших возрастных групп и взрослых. В связи с этим допускается проведение вакцинации по эмидемиологическим показаниям подросткам и взрослым. 6. Вирусные гепатиты В настоящее время имеются отечественные паротитные вакцины как в виде моновакцины, так и в сочетании с коревой вакциной. В современных условиях выявлено несколько этиологически самостоятельных гепатитов, которые обознаются буквами латинского алфавита: А, В, D, Е, С, F, W. Как свидетельствует В.Д. Учайкин, «эти нозологические формы не исчерпывают всех вирусных поражений печени у человека, и можно прогнозировать в недалеком будущем появление новых этиологически самостоятельных форм болезни». Наиболее полно изучены гепатиты А и В, что позволяет утверждать о возможности полной ликвидации этих заболеваний. Гепатит АТипичная кишечная инфекция, передается контактно-бытовым путем через загрязненные руки, инфицированную пищу и воду. Восприимчивость к вирусу достигает 70-100 %. Заболеваемость бывает спорадической, нередко в виде вспышек; на долю детей приходится более 60 % и чаще всего в возрасте 3–7 лет. Дети первого года практически не болеют: сохраняется трансплацентарный, материнский иммунитет, пока еще незначительны контакты с внешней средой. Источником инфекции является больной человек, причем выделение вируса из кишечника и с мочой отмечается задолго до появления первых признаков болезни (повышение температуры, резкое угнетение аппетита, тошнота, иногда рвота, в желтушный период – обесцвеченный стул, темная моча, истеричность склер и др.). В этой связи еще раз следует подчеркнуть необходимость соблюдения в детском коллективе строгого противоэпидемического режима (особый контроль за питанием, качеством воды, личной гигиеной). Заболевший ребенок должен быть изолирован и госпитализирован. Исход болезни, как правило, благоприятный. Карантин в очаге устанавливается на 35 дней. У всех контактных детей ежедневно проводится осмотр кожи, склер, отмечается размер печени, окраска мочи и кала. Для выявления атипичных форм возможно определение в сыворотке крови печеночных ферментов и антител (АлАТ и анти-ВГА IgM). Для купирования вспышки в очаге определенное значение имеет введение 1 мл – 10 % иммуноглобулина в течение 7-10 дней от первого случая заболевания. Однако возможности подобной пассивной иммунизации все же ограничены и ее защитный эффект сохраняется не более 5–6 месяцев (повторное введение иммуноглобулина небезразлично для организма из-за опасности накопления антиглобулинов). Радикальное решение проблемы предупреждения гепатита А находится только на пути активной иммунизации, что особенно важно для детей домов ребенка. Вакцинацию против гепатита А проводят двукратно, с интервалом 6-12 месяцев, начиная с 1,5–2 лет. Вакцинальные реакции практически отсутствуют, защитный иммунитет формируется у 95 % привитых. К сожалению, пока обязательная поголовная иммунизация детей против гепатита А не проводится, и эта вакцина не включена в национальный календарь прививок. Однако по эпидемиологическим показаниям, при вспышке гепатита А, а также в домах ребенка вакцинация должна проводиться. С этой целью можно воспользоваться вакциной хаврикс 720 (для детей) – фирма «Смит Кляйн Бигем» (Бельгия). Есть и другие вакцины: аваксим («Авентис Пастер», Франция), вакта (Нидерланды), получена и отечественная вакцина (Г.П. Вектор – Би Альгам, г. Новосибирск). Есть сведения, что после однократного введения вакцины аваксим накопление антител происходит уже к концу первой недели, почему ее начинают использовать для экстренной профилактики в очагах вместо пассивной иммунопрофилактики. Подъем заболеваемости гепатитом А до уровня 100/100 тыс. населения рассматривается как эпидемия. В Московском регионе эпидемиологическая обстановка тревожная, заболеваемость в среднем колеблется от 95,8 до 52,9/100 тыс. В связи с этим рекомендуется иммунизация не только детей, но и персонала детских учреждений, работников в сфере общественного питания. Гепатит ВПротекает в различных клинико-морфологических вариантах: от «здорового» носительства до злокачественных форм: хронического гепатита, цирроза печени и рака (карциномы). В настоящее время (по некоторым данным) в мире насчитывается около 300 млн вирусоносителей. Процент «здорового» носительства у населения неодинаков в разных регионах мира: от 1 % (США, Канада, Австрия, Центральная и Северная Европа) до 20–50 % (тропическая Африка, острова Океании, Юго-Восточная Азия); в Российской Федерации около 5 %. У всех инфицированных («здоровые» носители, больные) вирусный антиген обнаруживается практически во всех биологических средах организма, но максимальную его концентрацию и эпидемиологическую опасность представляют кровь, сперма и слюна. Передача инфекции осуществляется исключительно парентерально (плохо стерилизованные шприцы, иглы, режущие предметы), а также половым путем (почти 36 % заражений). Если же учесть, что более 50 % инфицируются при парентеральном введении наркотиков, делается понятным, что наркотики и беспорядочные половые контакты – фактическая угроза здоровью населения репродуктивного возраста. Не случайно на долю этой возрастной группы (от 15 до 30 лет) приходится 60–85 % всех заболеваний гепатитом В. Любопытно, что в Японии предусмотрена уголовная ответственность за нанесение татуировки лицам моложе 20 лет. В детском возрасте преобладают другие пути передачи инфекции. Так, по данным В.Ф. Учайкина, 29,8 %– это переливание крови, плазмы; 45,2 %– различные парентеральные манипуляции (инъекционное введение лекарственных средств), 25 – бытовые контакты. Последнее может реализоваться при тесном бытовом общении, в том числе в закрытых детских учреждениях. Заражение детей от матерей – носительниц вируса гепатита В чаще всего происходит во время родов, когда инфицированные околоплодные воды проникают через мацерированные кожные покровы и слизистые оболочки ребенка. Трансплацентарная передача осуществляется сравнительно редко (около 10 %). Для предупреждения заражения новорожденных все беременные обследуются дважды: при взятии женщины на учет (8 недель беременности) и при уходе в декретный отпуск (32 недели). После рождения ребенка матерью-вирусоносителем или больной острым гепатитом в последние месяцы беременности младенцу сразу же вводится иммуноглобулин с высоким содержанием антител. Сейчас разработан отечественный препарат гепатект – иммуноглобулин из сыворотки здоровых доноров, вакцинированных против гепатита В, т. е. осуществляется насыщенная пассивная профилактика. В настоящее время проблемы вирусного гепатита В во многом решаются благодаря созданию рекомбинантной вакцины и ее обязательному включению в национальный календарь прививок, что обеспечивает активную профилактику. В результате вакцинации заболеваемость гепатитом В стала отчетливо снижаться. Для вакцинации используется отечественная вакцина комбитек, а также энджерикс В («Смит Кляйн Бигем», Бельгия), эувакс В («Авентис Пастер», Франция), HB-vax («Мерк Шарп Доум», Нидерланды) и др. Прививки выполняются по схеме 0-1-6 месяцев, что обеспечивает надежный защитный эффект. Противопоказания фактически отсутствуют. Вакцина безопасна и ареактогенна. Кстати сказать, подобная вакцинация способствует снижению и гепатита D, так как вирус гепатита D для своего внедрения нуждается в присутствии вируса гепатита В. Гепатит СВ настоящее время особую опасность представляет гепатит С, имеющий сходные с гепатитом В пути распространения и формы заболевания, в том числе и «здоровое» носительство, но отсутствует возможность активной специфической защиты от этой инфекции: вакцины нет и пока не ясна перспектива ее создания. Вместе с тем хронизация при гепатите С наступает в 60–80 % случаев, что в 15 раз превышает хронизацию при гепатите В. Возможность инфицирования плода при гепатите С у беременной не превышает 6 %. После рождения, так же как и при гепатите В, до 12–18 месяцев у ребенка могут обнаруживаться материнские антитела. При их дальнейшем исчезновении его можно считать здоровым. Наоборот, сохранение антител свидетельствует об инфицированности. Дополнительные сведения о противоэпидемиологическом режиме можно получить в разделе «Профилактика ВИЧ-инфекции». 7. Острая респираторно-вирусная инфекция (ОРВИ) Число респираторных вирусов в настоящее время достигает 130. Среди них по масштабности, агрессивности и тяжести течения болезни лидирует вирус гриппа. Кроме того, к респираторным относятся респираторно-синцитиальный вирус, вирус парагриппа, аденовирус и многие другие. Все они вызывают, в той или иной степени, инфекционный токсикоз с вовлечением в процесс нервной и сердечно-сосудистой системы и, как правило, поражение слизистой дыхательных путей. ОРВИ – самые распространенные заболевания, и ежегодно в мире регистрируется до 1 млрд больных. В нашей стране их более 30 млн, причем 70 % приходится на детский возраст. Дети первых месяцев жизни болеют сравнительно редко: сохраняется материнский трансплацентарный иммунитет, а также благодаря относительной изоляции в этом возрасте от внешних контактов. Однако уже ко второму полугодию заболеваемость резко возрастает, в том числе в связи с увеличением контактов, и только после 3 лет, по мере приобретения иммунитета в результате перенесенных ОРВИ, она несколько снижается. Частая заболеваемость ОРВИ и ее отрицательное воздействие на формирование здоровья ребенка, его рост и развитие выдвигают эту проблему в число наиболее актуальных в педиатрии. 8. Грипп Его вирусы классифицируются на три самостоятельных типа-А, В, С. Лидирующее место принадлежит вирусу гриппа А. Его наружная оболочка содержит два гликопротеида, один из которых – гемагглютинин (Н) индуцирует образование антител, и в настоящее время известно его 13 подтипов. Другой гликопротеид – нейраминидаза(Ы)обеспечивает проникновение и «воспроизводство» в клетке вируса, имеет 10 подтипов. Процессы изменчивости гемагглютинина и нейраминидазы протекают независимо друг от друга и возможны самые различные их сочетания. Например, пандемия гриппа в 1918–1920 гг. вызвана вирусом A (H1N1), когда погибло около 20 млн человек, в 1957–1958 гг. азиатский грипп A (H2N2) унес жизни свыше 1 млн, в 1967 г. – гонконгский грипп A (H3N2), в 1978–1979 гг. – H1N1, в последние годы – H7N7. Смена одного антигена происходит практически каждые 2–3 года, тогда как смена двух антигенов одновременно – явление редкое. Таким образом, благодаря изменчивости гликопротеидов (Н и N) периодически возникает новый вариант возбудителя, к которому население может не иметь иммунитета, что приводит к стремительному росту заболеваний. Этому способствуют легкость передачи инфекции (воздушно-капельный путь – чихание, кашель и пр.), короткий инкубационный период (от нескольких часов до двух суток), всеобщая восприимчивость людей к вирусу гриппа. Эпидемические вспышки возникают, как правило, в зимнее время (скученность, низкая температура, витаминный дефицит и прочее). Вирус гриппа В подвержен меньшей изменчивости и вызывает только локальный подъем заболеваемости, вирус С порождает отдельные редкие спорадические заболевания. Источником вируса является больной человек с конца инкубации и весь лихорадочный период. После перенесенного гриппа создается стойкий иммунитет; повторное заражение обусловлено, как правило, заражением новым серовариантом вируса гриппа. Вакцинопрофилактика гриппа в современных условияхМногие годы активная профилактика детей как живыми, так и инактивированными вакцинами была мало востребована. Не наблюдалось эффективного результата, а повышение температуры и другие проявления гриппозной инфекции при введении живой вакцины создавали отрицательную реакцию на подобную прививку. В последние годы на основе генной инженерии были созданы расщепленные (сплит) вакцины, при которых гриппозный вирус освобождается от липидного слоя и других реактогенных компонентов, провоцирующих поствакцинальные реакции, но благодаря сохранению гемагглютинина и нейраминидазы сохраняется необходимое воздействие на иммунную систему человека, что обеспечивает активную продукцию противогриппозных антител. К расщепленным (сплит) вакцинам относятся ваксигрипп («Авентис Пастер», Франция) и флюарикс («Смит Кляйн Бигем», Бельгия), которые обеспечивают должный эффект и в педиатрической практике. К этой же группе относятся вакцины бегривак (Германия), инфлювак (Нидерланды), но они пока не получили у нас значительного распространения. В нашей стране разработан еще один вариант современной противогриппозной вакцины, где вирион освобожден не только от липидного слоя и реактогенного содержимого, но и от внутренних антигенов, что доводит до минимального уровня реактогенность вакцины. Это субъединичная вакцина. Вместе с тем, чтобы обеспечить и необходимое образование антител, в состав субъединичной вакцины включается иммуномодулятор – полиоксидоний. Так была создана отечественная вакцина гриппол. Ее должная эффективность доказана, а доступность цены, благодаря отечественному производству, делает ее весьма востребованной в широкой медицинской практике. Все эти вакцины малореактогенны и фактически не имеют противопоказаний, за исключением гиперчувствительности к куриному яйцу. Как уже отмечалось, вирус гриппа отличается крайней неустойчивостью своего антигенного состава, который меняется почти каждые 2–3 года; следовательно, гриппозная вакцина также должна трансформироваться с учетом этих изменений. Бесплатные вакцины предназначены прежде всего для группы риска. Группы высокого риска заражения и передачи вируса: • Дети дошкольного возраста, особенно находящиеся в коллективе, в домах ребенка, а также школьники, прежде всего интернатных учреждений. • Медицинский и педагогический персонал, работающий с детьми. • Работники сферы обслуживания, транспорта, учебных заведений. • Воинские контингенты. • Лица старше 65 лет, а также страдающие хроническими заболеваниями. Схема введения противогриппозных вакцин: ваксигрипп, флюарикс, гриппол детям от 6 месяцев до 3 лет по 0,25 2 раза с месячным интервалом; старшие дети и взрослые получают 0,5 однократно. Местный иммунитет формируется уже через 2 дня, а гуморальный – спустя 1–2 недели, держится более года, а иногда и до 3 лет. Проводить прививки против гриппа рекомендуется накануне эмидемической волны или в ее начале ежегодно, учитывая трансформацию вируса. Сплит-вакцины дают положительный результат (сероконверсию) в 73–84 % случаев, субъединичные – 53–73 %, т. е. результат достаточный, чтобы сбить эпидемическую волну. Следует учесть, что разные штаммы вируса гриппа имеют общие антигены, поэтому эффект от прививки отмечается, даже если эпидемия вызвана вирусом, отличным от прогнозируемого. Вот почему вакцинопрофилактика по своей доступности и эффективности является основным средством современного купирования эпидемии гриппа. 9. ВИЧ – вирус иммунодефицита человека. Особенности ВИЧ у детей. Диагностика. Диспансеризация Общая характеристика Заболевание впервые описано в 1981 г. в США, а в 1984-м был выделен вирус иммунодефицита и созданы тест-системы для его выявления. Наибольшее распространение, инфицированность и заболеваемость отмечаются в странах Африки, где уже сейчас (Заир, Замбия) носительство вируса среди взрослого населения достигает 10–20 %. В США общая инфицированность ВИЧ составляет примерно 100 на 100 тыс. населения, в странах Западной Европы – 20–30/100 тыс. В целом к началу XXI в. в мире насчитывалось более 50 млн инфицированных. А если учесть, что продолжительность их жизни достигает 5-10 лет, то вполне вероятна возможность инфицирования немалого числа партнеров, имевших с ними половые контакты. Принято считать, что число больных и инфицированных во всем мире удваивается каждый год. Поэтому любая опубликованная новая цифра, по мнению американских специалистов, быстро устаревает. В общей сложности за 20 лет пандемии от СПИДа умерли 10 млн человек. Механизм развития СПИДаВирус иммунодефицита человека относится к лентивирусам, которые входят в группу ретровирусов. В состав последних включены и многочисленные онковирусы, вызывающие опухоли, преимущественно у животных, но если онковирусы провоцируют пролиферативный рост пораженных клеток, то вирус СПИДа – их гибель. Сущность болезни определяется избирательным поражением вирусом Т лимфоцитов-хелперов (Т4-лимфоцитов). Это становится возможным благодаря наличию намембране Т4-лимфоцита рецептора CD4, родственного вирусному белку Р120. Происходит связывание этого белка с CD4, и вирус свободно проникает в Т, где в виде провируса находится в клетке в течение неопределенного времени. Дальнейшая судьба провируса зависит от ряда причин. В одних случаях происходит быстрое разрушение инфицированных клеток и быстрое заражение новых, в других – провирус задерживается в неактивном состоянии, а под влиянием другой инфекции – активизируется. В любом случае в процессе нахождения вируса внутри Т4-лимфоцита снижается функция последнего и происходит его разрушение, а по мере заражения все новых Т4-лимфоцитов их количество снижается, что приводит к разрушению иммунной системы организма. В связи с этим человек становится беззащитным перед случайными, в том числе и «оппортунистическими», инфекциями, которые в обычных условиях для него не опасны. Наряду с поражением Т4-лимфоцитов, вирус СПИДа одновременно поражает и клетки центральной нервной системы (ЦНС), так как последние на своей мембране также содержат рецептор CD4. Источником инфекции является только зараженный человек, больной или вирусоноситель. Из организма вирус выделяется преимущественно со спермой и менструальной кровью. В других биологических жидкостях (слюна, слезы, грудное молоко) содержание вируса минимально. Восприимчивость к ВИЧ фактически поголовная. Передача вируса осуществляется при половом контакте, при переливании вируссодержащей крови и ее препаратов. Так, доля больных СПИДом, инфицированных гемотрансфузиями, колеблется от 2 до 10 %. Наибольшее их число зарегистрировано среди больных гемофилией, что связано с поступлением в их кровь факторов свертывания VIII и IX, которые получаются при объединении крови от многих доноров. Опасны инъекционные вмешательства в случае использования инструментария, загрязненного кровью инфицированного человека. Теоретически заражение может произойти при тесном контакте через микротравмы, порезы, укусы и т. д. в случае, если вируссодержащий материал (кровь, сперма) попадет на поврежденные кожные покровы или слизистые оболочки. Допускается возможность заражения через ножницы, маникюрные принадлежности, бритвы и т. д. при попадании на них инфицированной крови. Внутриутробное заражение детей происходит с 15-й недели беременности, когда ВИЧ проникает в плод с кровью матери через плаценту. Инфицирование ребенка возможно и во время прохождения родовых путей. Доказано заражение и через грудное молоко. Сопоставления свидетельствуют, что если в 1 мл крови содержится 3000 ед. ВИЧ, то в грудном молоке менее 1 единицы. Однако если заражение женщины произошло после родов, концентрация вируса может увеличиваться в 50 раз. В итоге до 25–50 % детей, родившихся от инфицированных матерей, заражаются ВИЧ. Периоды болезниИнкубационный период – от 2 недель до 2 месяцев. Его длительность зависит от путей заражения: при гемотрансфузиях он короткий, при половых контактах – более длительный. Первичные проявления отмечаются примерно у половины инфицированных: повышается температура (может удерживаться до 2 недель), увеличиваются лимфатические узлы, возможно увеличение печени, селезенки, развитие ангины, в крови – лимфопения. У другой половины – только потливость, увеличение лимфатических узлов, снижение лимфоцитов в крови. Вслед за этим наступает скрытый период, который может длиться ряд лет, сопровождаться в основном перемежающимся увеличением лимфатических узлов, потливостью. Следующая стадия – пре-СПИД, когда отмечается не только увеличение лимфатических узлов, но и повышение температуры, потливость, а также повторные ОРВИ, рецидивирующие бронхиты, отиты, пневмонии. На коже – явления герпеса, грибковые поражения, гнойничковые высыпания, упорные кандидозные стоматиты. Период развернутого СПИДа. В зависимости от выраженности ведущего клинического синдрома условно различают легочную, церебральную (нервную), желудочно-кишечную, онкологическую и другие формы болезни, причем зачастую отмечается их сочетание, особенно в заключительную терминальную стадию. Особенности ВИЧ у детейДети, инфицированные ВИЧ внутриутробно, часто рождаются недоношенными, с внутриутробной гипотрофией и различными неврологическими нарушениями. Они плохо развиваются, страдают рецидивирующими инфекциями, постоянно отмечается увеличение лимфатических узлов, печени, селезенки. Первичным признаком болезни нередко является упорный генерализованный кандидоз, проявляющийся обширной молочницей, стоматитом, поражением кожи, а также геморрагическими симптомами (снижаются тромбоциты). У детей часто развивается церебральная (нервная) форма, которая сопровождается под острым энцефалитом, парапарезами, а также хроническим менингитом и пр. Легочная форма нередко протекает в виде цитомегаловирусной пневмонии с гиалиновым перерождением мембран, с тяжелыми приступами цианоза. Характерна упорная диарея. При внутриутробном заражении весь этот процесс может длиться от 2 месяцев до 5 лет, т. е. летальный исход наступает в более ранние сроки болезни, чем у взрослых, и сопровождается чаще всего возникновением сепсиса, вызываемого условно-патогенными микробами, грибами и простейшими. Таким образом, вырисовывается целая серия клинических признаков, которые позволяют заподозрить у ребенка развитие СПИДа и могут служить основанием для направленного обследования: длительная лихорадка, упорная диарея, кашель, сохраняющийся более месяца (несмотря на проводимое лечение), снижение массы тела более 10 %, упорный стоматит, рецидивирующий кандидоз, особенно в сочетании с энцефалопатией, стойким увеличением печени и селезенки, лимфатических узлов в 2–3 группах, затяжной пневмонией и другими «оппортунистическими» инфекциями. ДиагностикаДиагноз ВИЧ-инфекция ставится на основании совокупности клинических признаков, эпидемиологических и лабораторных данных. Решающее значение имеет прямое обнаружение вируса в крови. Однако этот метод не нашел широкого применения: с одной стороны – малая его доступность в практических условиях, но главное – из-за больших колебаний уровня вирусемии нередко получаются отрицательные результаты. Практическое значение для подтверждения диагноза имеет обнаружение специфических антител (метод иммуноферментного анализа – ИФА). Антитела обнаруживаются уже через месяц от начала заражения. Однако возможны и ложноположительные результаты, поэтому исследование приходится повторять. Максимальное накопление антител отмечается к 3 месяцам после заражения, через 6 месяцев их содержание снижается до 5–9%, а в поздние сроки до 1 %. В стадии СПИДа антитела могут отсутствовать, но из-за массивного разрушения клеток возможно выявление ВИЧ-инфекции. В этой заключительной стадии антитела способны нейтрализовать вирус, циркулирующий в крови, но внутриклеточный ВИЧ для них недоступен. В качестве дополнительных методов лабораторной диагностики при ВИЧ используется определение количества Т4-лимфоцитов, которое резко снижается. Так, если в норме, без иммунодефицита, отношение Т4/Т8 равно 1,8–2,2, то при СПИДе оно менее 1,0 Диагностическое значение могут иметь резкое увеличение в крови иммуноглобулинов классов A, G, Е, а также прогрессирующая лимфопения, эритропения, тромбоцитопения и эозинофилия. Лечение комплексное, проводится по нескольким направлениям. Первое – воздействие на вирус. В качестве противовирусных препаратов используются азидотимидин (АЗТ), дидезоксицитидин (ДДЦ), диданозин (ДДН), циклоспарин А, интерферон (лейкоцитарный) и др. Второе – восстановление иммунитета, для чего применяются препараты тимуса: тималин, тактивин, тимазин, интерлейкин-2, левамизол (декарис) и др. Третье – иммунозаместительная терапия: переливание лимфоцитарной массы, пересадка костного мозга, плазмаферез и др. Четвертое – лечение оппортунистических инфекций и онкологических заболеваний. В конечном итоге стоимость комплексного лечения в год составляет 200–250 тыс. руб. (В.В. Покровский). С другой стороны, необходимость ежедневного усвоения большого числа медикаментозных средств на протяжении всей жизни делает прогноз этого заболевания крайне тяжелым. Достаточно сказать, что среди больных, выявленных до 1982 г., к настоящему времени умерло около 90 %. Диспансеризация при ВИЧ-инфицированностиДиспансеризация проводится в зависимости от выраженности инфекции. Первая группа – инфицированные ВИЧ без клинических проявлений. Обеспечиваются регулярным медицинским осмотром и раз в год осуществляется госпитализация в специализированный стационар, где проводится всестороннее обследование и обсуждается план дальнейшего лечения. Остальное время дети находятся по месту своего проживания, контактируя со всеми окружающими, режим общий. Вторая группа включает ВИЧ-инфицированных с клиническими признаками заболевания (длительная лихорадка, увеличение лимфатических узлов, потливость, симптомы энцефалопатии и др.). Эти больные дважды в год госпитализируются в специализированный стационар. Режим щадящий, контакты ограничены. Третья группа – больные с оппортунистическими инфекциями (пневмоцистная пневмония, генерализованный кандидоз и герпетическая инфекция, цитомегалия и прочее). Они должны находиться в стационаре до стойкой стабилизации состояния. Профилактика ВИЧ-инфекцииПротивоэпидемический режим при наличии ВИЧ-инфицированных детей предусматривает должную обработку предметов, которыми пользуется ребенок. Так, белье, зубные щетки, игрушки, перевязочный материал дезинфицируются кипячением в течение 20–25 мин, инструменты, катетеры, зонды из резины на 15 мин помещаются в моющий раствор при t +50 °C. Моющие растворы должны иметь разрешение на применение в детском учреждении. Биологические материалы дезинфицируют гипохлоридом Na в соотношении 1:5 в течение часа, а затем – в канализацию. Посуду, предметы ухода обезвреживают в течение часа в 3 %-ном растворе хлорамина, 4 %-ном растворе перекиси водорода с моющим средством – 0,1 %-ным раствором сульфохлорантина. Для санитарно-технического оборудования можно использовать Доместос. Обслуживающий персонал, а также сотрудники лабораторий должны обследоваться на наличие антител к ВИЧ один раз в год. Важное значение имеют клинический и серологический контроль за донорами крови, применение шприцов разового использования и др. Наряду с внутриутробным инфицированием заражение детей может произойти в семьях высокого риска (больные СПИДом, наркоманы, работники секс-бизнеса). В конечном итоге следует учитывать, что при работе с инфицированными детьми заражение возможно в основном только при попадании крови этих детей (порезы, ушибы, укусы и др.) на поврежденную кожу, слизистые. Следовательно, при таких ситуациях обработку необходимо осуществлять в перчатках одноразового применения, а использованный перевязочный материал соответственным образом обрабатывать и ликвидировать. Активная профилактика находится в стадии разработки. Ожидается, что в ближайшие 5-10 лет будут получены эффективные и безвредные вакцины против ВИЧ-инфекции. Однако высокая степень изменчивости вируса иммунодефицита вносит большие сомнения в эти оптимистические ожидания. Беременность и ВИЧС каждым годом сокращается разница в частоте инфицированности ВИЧ между мужчинами и женщинами. Так, если в 1982 г. это соотношение составляло 15:1, то в 1990-м – 9:1, в 1995-м – 4:1. На первых этапах этого процесса заражение чаще всего происходило через инъекционные наркотики, в настоящее время резко возрастает процент половой передачи. Естественно, что наибольшая часть инфицированных женщин – это женщины детородного возраста, поэтому растет число детей, рожденных от ВИЧ-инфицированных матерей. Так, в 2000 г. в РФ родилось почти 2 тыс. таких детей, в 2003 г. – уже 4 тыс. В целом за последние 6 лет число ВИЧ-инфицированных беременных выросло в 450 раз. Следовательно, появились новые сложные, ранее не известные проблемы, которые приходится решать в повседневной практике. Так, в настоящее время ВИЧ-инфицированным беременным рекомендуется вводить азидотимидин (АЗТ) или его новую разновидность – ретровир, что снижает риск заражения плода в 3–4 раза. Есть отечественный аналог – тимазид. К сожалению, спустя несколько месяцев к АЗТ и его производным формируется привыкание не только у женщин, но и у их детей. Поэтому разрабатываются и другие препараты. Так, фосфазид (или зидофудин) снижает внутриутробное инфицирование почти в 3 раза. В итоге назначение современных препаратов ВИЧ-инфицированной беременной и в усиленном режиме – в родах, а также ребенку в первые дни жизни позволяет снизить риск передачи ВИЧ с 25–50 до 0,5 % (И. Шамов). Благодаря этим средствам в середине 90-х годов XX столетия удалось снизить темпы распространения ВИЧ-инфекции в Европейском регионе и Северной Америке, так как они обеспечивают и определенный противоэпидемический эффект. Предлагается наряду с антивирусной терапией проводить кесарево сечение при ВИЧ-инфицированности, чтобы исключить возможность заражения плода при его прохождении через родовые пути. Грудное вскармливание все же рискованно, особенно если заражение женщины произошло после родов. По последним данным, немало детей, родившихся от ВИЧ-инфицированных матерей, оказываются свободными от заражения. Однако после рождения в их крови могут содержаться материнские тела против ВИЧ. С другой стороны, иногда у ВИЧ-инфицированной матери могут и отсутствовать антитела – в зависимости от сроков ее заражения, а следовательно, они могут отсутствовать и у ее ребенка. Таким образом, в том и другом случае необходимо повторное обследование малыша. Его следует проводить в 6 месяцев, когда материнские антитела уже отсутствуют. С другой стороны, к этому сроку, а иногда и позже, если все же заражение ребенка состоялось, могут появиться «собственные» антитела. Поэтому для окончательного решения вопроса об инфицированности обследование необходимо провести в годовалом возрасте и далее – в 1 год 6 месяцев. В конечном итоге дети, не зараженные от ВИЧ-инфицированных матерей, снимаются с диспансерного учета только в 3 года. Проблемы «отказных» детейСреди ВИЧ-инфицированных детей основная их часть, как известно, это дети, от которых отказываются матери. Как уже подчеркивалось, только в возрасте года-полутора лет ребенка можно определить, инфицирован он или нет. Сразу после рождения такие дети оказываются в инфекционной больнице, в структуре которой находится центр по профилактике и борьбе со СПИДом. Однако их годичное пребывание в этих условиях невозможно. Вопросы дальнейшего пребывания таких детей в подобных центрах сейчас активно обсуждаются медицинской общественностью. Возникают предложения о создании для «отказных» инфицированных детей специализированных учреждений типа домов ребенка. Вместе с тем пребывание ребенка в подобном учреждении является нарушением его прав по сохранению врачебной тайны о его заболевании, это записано в федеральном законе «О предупреждении распространения в Российской Федерации ВИЧ-инфекции». Таким образом, эти дети с первых месяцев жизни оказываются в доме ребенка, и наряду с другими проблемами приходится решать вопрос и по их активной специфической защите от других инфекций, т. е. о вакцинопрофилактике. Причем в подобной защите ВИЧ-инфицированные дети крайне нуждаются с учетом их особой восприимчивости из-за снижения иммунологических возможностей. Поэтому именно эти дети должны получить прививки против HIВ-инфекции (после 6 месяцев), менингита, гепатита А и особенно против пневмококковой инфекции (в 2 года), так как пневмококк – самый частый возбудитель осложнений и обострений у ВИЧ-инфицированных детей. Что касается обязательных, т. е. календарных, вакцин, то здесь установки следующие: • вакцину против гепатита В должны получать все дети по утвержденной схеме; • ADC как «неживая» вакцина вместе с полиомиелитной инактивированной (ИПВ) вводится в принятые сроки на первом году, когда диагноз инфицированности еще неясен. Наблюдения свидетельствуют, что и AKDC также в соответствующие сроки может вводиться, с предварительным назначением (за 1–2 недели) поливитаминов; • против кори, краснухи, паротита, как известно, применяются «живые» вакцины с годовалого возраста, когда уже имеется ясность в отношении ВИЧ-инфицированности. К последней группе вакцин отношение неоднозначное. С одной стороны, из-за разрушения иммунной системы при ВИЧ возможны тяжелые реакции на эти («живые») вакцины, с другой – заражение корью, причем летальность у этих детей – 100 %. Очевидно, следует руководствоваться эпидемиологической обстановкой по кори в регионе. Так, в Москве она весьма неустойчивая, что позволяет идти на эту рискованную вакцинацию. ВИЧ и туберкулезОсобо следует сказать о прививках против туберкулеза вакциной БЦЖ. Эта «живая» вакцина, представленная ослабленным возбудителем туберкулеза рогатого скота (М. Bovis), позволяет снизить заболеваемость у детей в 10–15 раз, поэтому всем здоровым новорожденным на 3-7-й день жизни вводится эта вакцина. Однако дети, рожденные от ВИЧ-инфицированных матерей, не прививаются в роддоме. Связано это с тем, что ВИЧ разрушает популяцию СБ4-лимфоцитов, которая играет ключевую роль в формировании противотуберкулезного иммунитета, поэтому введение даже ослабленного туберкулезного возбудителя вызывает тяжелые последствия у этих детей. Так, описаны отдельные случаи диссеминированной БЦЖ-инфекции, когда сведения о ВИЧ-инфицированности были получены после введения вакцины. Поэтому все дети, рожденные от ВИЧ-инфицированных матерей, не прививаются на протяжении первых 1,5 лет жизни. В дальнейшем ВИЧ-инфицированным детям эта вакцинация не проводится. Что касается другой группы детей, у которых заражение не произошло, то решение зависит от обстановки и условий проживания. Так, если в окружении сохраняется опасность ВИЧ-инфицирования, вакцинация не проводится и в последующие периоды жизни ребенка. При устранении этой опасности прививки БЦЖ проводятся при неблагополучной эпидемиологической ситуации по туберкулезу. ГЛАВА 3. Антибактериальная терапия в условиях интернатного учреждения Антимикробная химиотерапия ведет свое начало с 1936 г. – времени появления в клинической практике первого сульфаниламидного препарата; спустя 5 лет был впервые применен в клинике антибиотик пенициллин. Сегодня известно более 6 тыс. природных антимикробных препаратов и десятки тысяч полусинтетических производных. Но наибольшее практическое значение имеют около 50 антибиотиков, выпускаемых в разнообразных лекарственных формах. Антимикробная химиотерапия рассматривает взаимодействие трех основных компонентов: микроорганизм, лекарственное средство, макроорганизм. Особенности каждого из компонентов влияют на выбор антимикробного средства при лечении. К основным характеристикам микроорганизмов относят: патогенность, вирулентность, метаболическую активность, инвазивность. Патогенность – способность микроорганизмов вызывать инфекционное заболевание у человека. Выделяют патогенные бактерии (Shigella dysenteriae – дизентерия, Yersinia pestis – чума) и условно-патогенные бактерии (Staphylococcus aureus, Streptococcus pneumoniae, Escherichia coli и др.). Вирулентность – степень патогенности. Метаболическая активность – продуцирование бактериями биологически активных веществ (например, экзотоксинов, ферментов, бета-лактамаз и др.). Инвазивность – способность микроорганизмов преодолевать защитные барьеры и диссеминировать (распространяться) в макроорганизме. Сегодня хорошо изучены возбудители, вызывающие вне-больничные заболевания дыхательных путей (табл. 10). Таблица 10 Наиболее значимые возбудители внебольничных инфекций дыхательных путей По степени чувствительности к антибактериальным препаратам бактерии разделяются на чувствительные, умеренно чувствительные и резистентные. К чувствительным относят возбудителей, рост которых прекращается при терапевтических концентрациях лекарств в крови. Для умеренно чувствительных микроорганизмов требуются максимальные дозы лекарственного препарата, чтобы добиться угнетения их роста. Устойчивые (резистентные) бактерии характеризуются бактериостатическим эффектом, который может быть достигнут только in vitro при высоких концентрациях лекарственного препарата, являющихся токсичными для человека. Резистентность (устойчивость) бывает природной и приобретенной. У некоторых микроорганизмов генетически отсутствует чувствительность к антимикробному средству (вирусы устойчивы к антибиотикам, грамотрицательные бактерии к бензилпенициллину или ванкомицину, микоплазма – к бета-лактамным антибиотикам), в этом случае имеет место природная резистентность. Приобретенная резистентность возникает в результате мутации отдельных штаммов бактерий и селекции устойчивых клонов или в результате внехромосомного (плазмидного) обмена генетической информацией между отдельными бактериальными клетками. Выделяют два типа приобретенной резистентности: • первичная резистентность бактерий имеет место до начала лечения антибиотиком (устойчивость некоторых штаммов золотистого стафилоккока или пневмококка к бензилпенициллину, гемофильной палочки – к ампициллину); • вторичная резистентность бактерий возникает или возрастает в процессе применения антибактериальных препаратов. • Снижение чувствительности к бета-лактамам; устойчивость в пенициллину в России менее 10 %. • Бета-лактамы сохраняют клиническую эффективность в отношении пенициллинрезистентных пневмококков. • Низкая природная активность пероральных цефалоспоринов III поколения. В настоящее время известно несколько механизмов взаимодействия приобретенной резистентности бактерий и антибактериальных средств, среди которых наиболее важными являются: изменение проницаемости клеточной стенки бактерий (модификация пориновых каналов) для антибактериальных препаратов; модификация клеточных структур – мишеней действия антибиотиков (например, пенициллинсвязывающих белков, SOS-субъединицы рибосом); продукция бактериями ферментов – бета-лактамаз, разрушающих бета-лактамное кольцо пенициллинов, цефалоспоринов, карбапенемов; активное выведение антибиотика (efflux) из бактериальной клетки. Резистентность некоторых наиболее значимых возбудителей внебольничных бактериальных инфекций представлена в табл. 11. Таблица 11 Резистентность некоторых наиболее значимых возбудителей внебольничных бактериальных инфекций (СВ. Сидоренко, 2002)  К основным характеристикам антибактериальных препаратов относят их классификацию, вопросы фармакокинетики и фармакодинамики. Понятие «антибактериальный препарат» – собирательное, оно объединяет: собственно антибиотики – соединения биологического происхождения, полу синтетические антибиотики – продукты химической модификации природных соединений и химиотерапевтические препараты – продукты полного химического синтеза, до сих пор в природе не обнаруженные. Это условная классификация по происхождению антибиотиков. В настоящее время такое деление не актуально, так как ряд природных антибиотиков получают путем синтеза (хлорамфеникол), другие являются синтетическими соединениями, а называются природными (фторхинолоны). Антибактериальные препараты (АБП) составляют весьма многочисленных группу разнородных по химической структуре и механизму действия на микробный агент лекарственных средств, а также по спектру действия на различные группы микроорганизмов. Отличительной характеристикой АБП любой химической структуры является их способность связываться с высокой степенью избирательности и аффинности с соответствующей мишенью – той или иной структурной молекулой бактериальной клетки либо ее ферментом, катализирующим ту или иную физиологически значимую функцию. Каждый АБП характеризуется определенным (избирательным) спектром своего действия, и широта такого спектра варьирует для различных АБП в весьма широких пределах – от одного бактериального рода до обширных групп, включающих многие семейства грамположительных и грамотрицательных бактерий. Выбор группы АБП обусловливается видом возбудителя и локализацией воспалительного процесса. В амбулаторной педиатрической практике при лечении респираторной инфекции используют в основном 6 подгрупп АБП (табл. 12). Таблица 12 Современные пероральные антибиотики для амбулаторной терапии респираторных инфекций у детей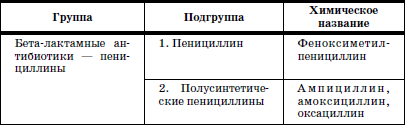 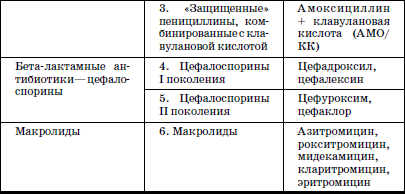 Различают АБП узкого спектра антимикробного действия, активные преимущественно в отношении грамположительных (природные или некоторые полусинтетические пенициллины, макролиды, фузидин, линкомицин и др.) или грамотрицательных(полимиксины) микроорганизмов; широкого спектра, активные в отношении как грамположительных, так и грамотрицательных микроорганизмов (тетрациклины, аминогликозиды, левомицетин, некоторые полусинтетические пенициллины, цефалоспорины, рифампицин); противотуберкулезные (стрептомицин, канамицин, рифампицин, флоримицин, циклосерин); противогрибковые (нистатин, амфотерицин В, гризеофульвин и др.); действующие на простейших (мономицин); противоопухолевые (актиномицины, антрациклины, блеомицины и др.). Антибактериальные препараты делятся, как и другие лекарственные средства, на группы и классы, что определяется не только спектром активности, но и фармакокинетическими особенностями и характером нежелательных реакций. Но при этом нельзя рассматривать все препараты одной группы как взаимозаменяемые. Даже препараты одного поколения имеют различную клиническую эффективность. Например: цефтазидим и цефоперазон эффективны против синегнойной палочки, а цефотаксим и цефтриаксон не обладают такой активностью, хотя все эти препараты из одной группы цефалоспоринов III поколения. В клинической практике при терапии заболеваний имеет значение деление АБП на системные и местные (табл. 13). Таблица 13 Выбор системных антибиотиков при бактериальных инфекциях дыхательных путей у детей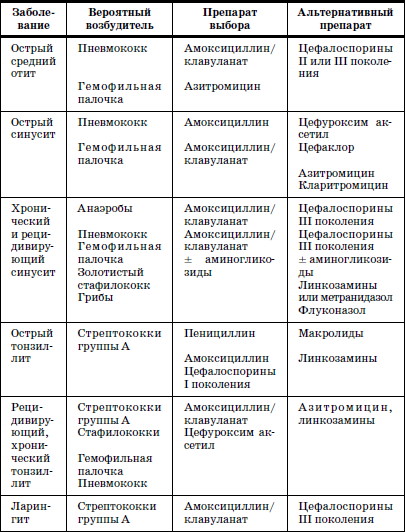 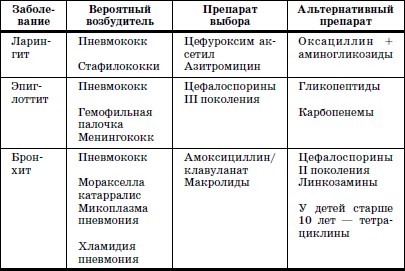 По основным механизмам противомикробного действия выделяют АБП, угнетающие синтез клеточной стенки бактерий (пенициллины, цефалоспорины, АБП из группы ванкомицина); нарушающие функции рибосом и процессы синтеза белков в микробных клетках (макролиды, аминогликозиды, тетрациклины, левомицетин, линкомицин); изменяющие проницаемость цитоплазматической мембраны микроорганизмов и обладающие детергентным действием на них (полимиксины, нистатин, леворин, амфотерицин В и др.); нарушающие синтез РНК бактерий (рифампицин). По характеру противомикробного действия АБП разделяют на бактерицидные (быстро вызывающие гибель микробных клеток) и бактериостатические (задерживающие рост и размножение микробных клеток). Бактерицидным действием обладают в основном АБП, угнетающие синтез клеточной стенки, нарушающие проницаемость цитоплазматической мембраны микроорганизмов или блокирующие в них синтез РНК. Для подавляющего большинства АБП, нарушающих внутриклеточный синтез белка и функции рибосом, характерно бактериостатическое действие на микроорганизмы. Исключением являются АБП из группы аминогликозидов, которые отличаются тем, что не только нарушают функции рибосом и внутриклеточный синтез белка, но и, вероятно, вторично (непрямым путем) угнетают синтез клеточной стенки микроорганизмов. Выделение бактерицидных и бактериостатических антибиотиков имеет основное практическое значение при лечении тяжелых инфекций. Обычно для достижения терапевтического эффекта используют антибиотики с бактериостатическим действием. Пациентам с нарушениями иммунитета следует назначать бактерицидные препараты. При необходимости назначения нескольких АМБ-препаратов следует избегать сочетаний лекарственных средств бактерицидного типа действия с препаратами бактериостатического действия. Это связано со значительным ослаблением противомикробного эффекта бактерицидно действующих препаратов бактериостатическими лекарствами. Из фармакокинетических характеристик наиболее важными при выборе препарата являются период полувыведения и биодоступность (для препаратов, принимаемых внутрь). В процессе антибиотикотерапии важное значение имеет назначение оптимальных доз и способов введения препаратов с учетом их фармакокинетики в организме больного. Оптимальными являются такие дозы АБП, при которых концентрация АБП в крови в 2–3 раза превышает величину его минимальной подавляющей концентрации в отношении выделенного возбудителя. Для больных с сопутствующей почечной недостаточностью при выборе антибиотиков и определении их доз необходимо принимать во внимание особенности фармакокинетики отдельных препаратов. Так, среди АБП имеются препараты (гентамицин, карбенициллин, цефалоридин, цефалексин и др.), выделение которых значительно уменьшается при почечной недостаточности, что способствует усилению их токсичности при данной патологии. Дозы таких АБП уменьшают в соответствии со степенью нарушения выделительной функции почек (по клиренсу креатинина). Коррекцию доз некоторых АБП (препаратов бензилпенициллина, ампициллина, оксациллина, линкомицина и цефалотина) проводят только при клиренсе креатинина менее 30 мл/мин. Выделение эритромицина, доксициклина, левомицетина, рифампицина и фузидина из организма при попечечной недостаточности не изменяется, поэтому данные АБП при нарушениях выделительной функции почек назначают в обычных дозах. Немаловажным является вопрос длительности антибактериальной терапии. Рекомендуемая длительность антибактериальной терапии при лечении бактериальных респираторных инфекций в амбулаторной практике представлена в табл. 14. Таблица 14 Рекомендуемая длительность антибактериальной терапии бактериальных респираторных инфекций в амбулаторной практике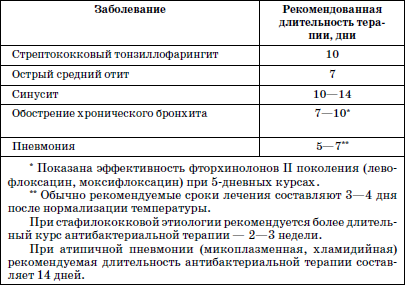 При назначении АБП следует учитывать особенности каждого лекарственного средства и особенно результаты их клинического применения, полученные в хорошо контролируемых клинических испытаниях. Вопросы рациональной антибиотикотерапии в интернатных условиях Проблема рациональной и своевременной антимикробной химиотерапии является на сегодняшний день одной из наиболее актуальных в амбулаторных условиях. Принимая решение о назначении лечения, врач должен ответить на многие вопросы: • Данные нарушения вызваны инфекцией или симптоматическим проявлением других состояний (аллергия, неинфекционное воспаление, заболевания других органов и систем и т. д.)? • Если это инфекция, то какие микроорганизмы ее вызвали: вирусы, бактерии, грибы? Если это вирусная инфекция, нет необходимости в назначении антибиотиков, так как они не оказывают противовирусного действия и не предотвращают развитие бактериальных осложнений. • Если это бактериальная инфекция, надо решить, нужен ли антибиотик в данном случае ил и можно ограничиться симптоматической терапией? Ряд бактериальных инфекций (например, легкие формы острого синусита или острого среднего отита у лиц с нормальным иммунитетом) не требуют назначения антибиотиков, так как частота выздоровления у пациентов, получавших антибиотики и плацебо, одинакова. После принятия решения о применении антибактериальной терапии необходимо выбрать конкретный препарат. Область применения антибактериальных препаратов при вне-больничных респираторных инфекциях в амбулаторной практике представлена в табл. 15. Таблица 15 Область применения антибактериальных препаратов при внебольничных респираторных инфекциях в амбулаторной практике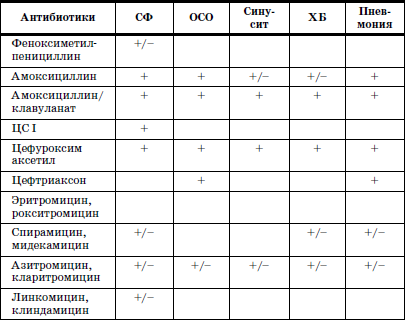 
Основные ошибки назначения АБП лихорадящим больным в интернатных условиях: • трактовка лихорадки как проявления инфекции; стремление к обязательному назначению лекарственного лечения в каждой клинической ситуации; • трактовка предполагаемой инфекции как бактериальной; • назначение АП без верификации бактериальной инфекции; • назначение АП больным вирусной инфекцией с целью «профилактики» бактериальной инфекции; • неадекватно длительная антибактериальная терапия в ожидании эффекта; • недооценка или невыявление дополнительных признаков (анамнестических, клинических, лабораторных и т. д.); • недооценка риска развития лекарственной устойчивости, нежелательных эффектов; • желание врача перестраховаться. Эффект лечения в интернатных условиях во многом зависит от адекватной оценки состояния ребенка врачом, преморбидного фона, вида инфекции, квалификации врача и т. д. Современные тенденции оптимизации антибактериальной терапии затрагивают несколько ключевых позиций: • повышение эффективности лечения путем внедрения современных протоколов эмпирической антибиотикотерапии; • разработка алгоритмов антибиотикотерапии; • применение современных антибиотиков с относительно высокой безопасностью с целью снижения частоты побочных реакций, осложнений суперинфекций; • применение адекватных доз препаратов; • внедрение щадящих режимов антибиотикотерапии для детей – отказ от инъекционных препаратов в амбулаторной практике, переход на однократный режим дозирования аминогликозидов и др. Множество новых разработок в области антимикробной химиотерапии делают лечение инфекций более эффективным. Но, с другой стороны, огромное количество препаратов с различными микробиологическими и фармакологическими свойствами затрудняет выбор подходящего лекарственного средства и нередко представляет большие трудности для врача в выборе лечебного средства при назначении больным с инфекцией или подозрением на инфекцию. Достичь высокой эффективности антибиотикотерапии можно лишь при использовании современных протоколов эмпирической антибиотикотерапии по основным нозологическим формам заболеваний. Ведущие специалисты в области педиатрии при разработке таких протоколов учитывают общие принципы выбора антибиотика, анатомо-физиологические особенности детского организма, а также особенности применения препарата в педиатрической практике во внебольничных условиях. Общие особенности антибиотиков хорошо известны, они связаны с особым местом среди других групп лекарственных средств. Имеются объективные проблемы, связанные с применением антимикробных препаратов, так как, во-первых, это самая обширная группа лекарственных средств (только антибактериальных препаратов насчитывается более 20 классов, в России зарегистрировано более 200 антибиотиков); во-вторых, это самая трудная для применения группа лекарств (требуются знания не только препаратов и механизмов их действия, но и основ клинической микробиологии). В России существуют объективные трудности микробиологической диагностики. Они связаны с общим низким уровнем исследований и отсутствием точности при их интерпретации; нет информации о многих инфекциях; недостаточное сотрудничество между микробиологами и клиницистами. Активность антибиотиков направлена на микроорганизмы, активность других лекарственных средств – на рецепторы макроорганизма. Достоинством антибиотиков является то, что в лаборатории их активность и клиническую эффективность можно прогнозировать с высокой степенью достоверности. При инфекциях этиологический возбудитель может быть выделен и изучен in vitro. Как правило, это возможно только через несколько дней, и часто этиологический диагноз устанавливается ретроспективно. Поэтому доминирующая роль при лечении инфекционных заболеваний в амбулаторных условиях принадлежит эмпирической терапии. Существуют общие принципы назначения антибактериальной терапии: • уровень природной активности антибиотиков в отношении наиболее вероятных возбудителей и распространение среди них приобретенной устойчивости (при эмпирическом назначении большинства антибиотиков выбор должен основываться на современных данных о наиболее частых возбудителях заболевания и их чувствительности к антибиотикам в регионе); • фармакокинетические, фармакодинамические и токсикологические свойства препаратов (способность проникать в определенной концентрации в очаг инфекции; в амбулаторной практике не следует применять котримоксазол – он может вызвать такие тяжелые аллергические реакции, как синдромы Стивенса-Джонсона и Лайелла, по спектру активности его могут заменить амоксициллин или амоксициллин/клавуланат); • наличие у антибиотиков подтвержденной клинической эффективности; • возможное влияние широкого применения антибиотика на распространение резистентности; • фармакоэкономические показатели (подразумевают под собой не простую стоимость упаковки препарата, но также обязательный учет клинической и микробиологической эффективности терапии, ее влияния на качество жизни); • удобство применения (для обеспечения комплаентности к терапии оптимальными являются пероральные препараты, которые применяются 1–2 раза в сутки и независимо от еды); • при положительном клиническом эффекте от проводимой терапии и отсутствии проявлений токсичности смена антибиотика обычно не производится; • при отсутствии эффекта от лечения АБП следует иметь в виду возможность фальсификации препарата. Необходимо подчеркнуть особенности применения антибиотиков в интернатных учреждениях: • приоритет следует отдавать пероральным формам лекарственных средств; • важно соблюдать стратегию минимальной достаточности – если в арсенале врача есть антибиотик, подходящий по спектру для лечения данного заболевания, то нет необходимости назначать другой препарат более широкой направленности или комбинацию препаратов (использование резерва необходимо оставить для стационаров, не провоцировать рост резистентных форм). Современные антибактериальные препараты для детей имеют ряд положительных качеств: • высокую активность в отношении основных патогенов (пероральные цефалоспорины II поколения и амоксициллин с клавулановой кислотой высокоактивны в отношении бета-лактамазопродуцирующих бактерий, устойчивых к антибиотикам пенициллиного ряда – пенициллин, ампициллин); • высокую биодоступность (сопоставимую с парентеральным введением, концентрации антибактериального препарата в тканях и биологических жидкостях достигают максимальных значений); • достигаются пролонгированный эффект и высокая эффективность при однократном приеме в день (макролид – азитромицин) или один раз в три дня (фосфомицин трометамол – при инфекции мочевыводящих путей); • разнообразие лекарственных форм, соответствующих возрастным особенностям детей (от капель и суспензий для самых маленьких до таблетированных форм и капсул для старшего возраста); • положительный эмоциональный настрой при лечении (замена инъекций приемом внутрь вкусного лекарственного препарата не вызывает негативных реакций на необходимость лечиться). Лечение современными оральными препаратами экономически выгодно за счет высокой эффективности (отпадает необходимость в госпитализации, дополнительных обследованиях), снижения частоты осложнений, затрат на инъекционные материалы и т. д. Следует обращать внимание на современные разработки доказательной медицины. Л.С. Страчунский выделяет приоритетные направления совершенствования антимикробной химиотерапии у детей в нашей стране: • внедрение принципов доказательной медицины в диагностику и лечение; • повышение внимания к клинической микробиологии, так как даже самые последние зарубежные публикации не могут заменить локальные данные по антибиотикорезистентности. В лабораториях необходимо наладить повседневную надежную идентификацию пневмококков, гемофильной палочки, пиогенных стрептококков и определение их чувствительности на основе международных стандартов; для стационаров – освоение методов выявления метициллинрезистентных стафилококков и бета-лактамаз расширенного спектра; • выделение в каждом регионе лаборатории, ответственной за мониторинг антибиотикорезистентности. Высокая эффективность и доступность современных антибиотиков позволила разработать стандарты антибиотикотерапии бактериальных инфекций у детей во внебольничных условиях и предположить щадящие пути введения препаратов, отказавшись по возможности от инъекций. Как пример приводим алгоритм лечения внебольничных пневмоний (табл. 16) и ран от укусов (табл. 18), поскольку в интернатных учреждениях эти формы патологии встречаются достаточно часто. Таблица 16 Выбор антибиотика при лечении типичной внебольничной пневмонии у детей 1 мес. – 15 лет (по В.К. Таточенко) Через 2 дня амбулаторного лечения детей с пневмонией проводится контроль по следующим признакам: Ухудшение • Не в состоянии пить. • Втяжение грудной клетки. • Другие опасные признаки. Улучшение • Нормализация частоты дыхания. • Снижение температуры. • Улучшение аппетита. При ухудшении показана немедленная госпитализация. При улучшении – окончание антибиотикотерапии через 5 дней. При отсутствии динамики – замена антибиотика или дополнение другого антибиотика, решение вопроса о госпитализации. Раны от укусов – повреждения, серьезность которых часто недооценивается воспитателями и врачами. Опасность укушенных ран, нанесенных человеком или животными, в том, что они обычно осложняются местными инфекциями, которые нередко приобретают генерализованный характер. В связи с этим, наряду с местной хирургической обработкой и профилактикой столбняка, важное место в лечении данной группы пациентов занимает антибактериальная терапия (табл. 17). Таблица 17 Применение антибактериальных препаратов при ранах от укусов у детей 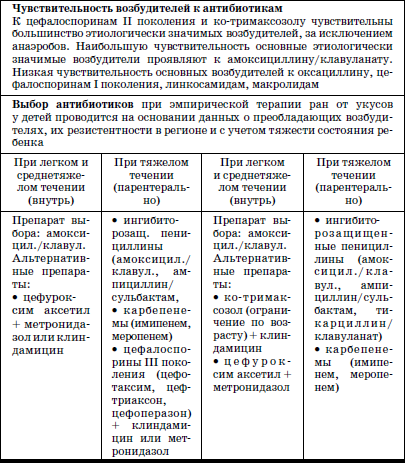 Длительность терапии: с профилактической целью проводят 3-4-дневные курсы антибиотикотерапии. При развитии целлюлита и абсцесса – 10–14 дней. ГЛАВА 4. Атопический дерматит Атопический дерматит является хроническим аллергическим заболеванием и развивается у детей с наследственной предрасположенностью. В основе болезни лежат воспалительные изменения кожи и изменение ее реактивности, которые нарушают естественную реакцию кожи на внешние и внутренние раздражители. Атопический дерматит – одно из самых распространенных аллергических заболеваний, его диагностируют у 10–28 % детей; в структуре же всех аллергических заболеваний доля атопического дерматита колеблется от 50 до 75 %. За последние десятилетия во всех экономически развитых странах отмечается неуклонный рост заболеваемости атопический дерматитом. Достаточно часто он наблюдается у детей, воспитывающихся в доме ребенка. Начало заболевания в большинстве случаев приходится на ранний детский возраст, а у 60–70 % детей отмечается на первом году жизни. Приобретая хроническое течение, болезнь сохраняет свои клинические признаки на протяжении многих лет. Тяжелые формы ее резко снижают качество жизни больного ребенка и способствуют формированию психосоматических расстройств. Почти у половины детей, страдающих атопическим дерматитом, в последующем развиваются бронхиальная астма, поллиноз, аллергический ринит. У 80 % детей, страдающих атопическим дерматитом, отмечается наследственная отягощенность по аллергическим заболеваниям. Причем чаще связь с ними выявляется по линии матери (60–70 %), реже по линии отца (18–22 %). При наличии атопических заболеваний у обоих родителей риск развития их у ребенка составляет 60–80 %, у одного из родителей – 45–50 %. Риск же формирования атопического дерматита у детей, родившихся у здоровых родителей, составляет всего 10–12 %. Врач дома ребенка должен выяснить все предпосылки возникновения этого страдания и исходное состояние здоровья ребенка. Конечно, неизбежные трудности выяснения семейного анамнеза детей в домах ребенка затрудняют проведение лечения, прогноз и профилактику атопического дерматита. Однако даже здесь нужно сделать все возможное, чтобы облегчить страдание детей и предупредить развитие инвалидизирующих состояний. Развитие атопического дерматита тесно связано с воздействием различных аллергенов, среди которых у детей раннего возраста доминируют пищевые аллергены. Практически любой продукт, используемый в питании ребенка, может стать причиной развития атопического дерматита, при этом частота возникновения аллергической реакции зависит от характера продукта и его индивидуальной переносимости. Большую роль в развитии атопического дерматита играют так называемые перекрестные реакции между различными группами пищевых аллергенов. Аллергические реакции на один пищевой продукт наблюдаются, как правило, у небольшой части детей (0,5–2%), у остальных отмечается сложная пищевая аллергия, в основе которой большую роль играют именно перекрестные реакции. Здесь важно отметить, что с возрастом пищевая аллергия теряет свою доминирующую роль. Так, у детей старше 3 лет на фоне сохраняющейся аллергии к белкам коровьевого молока, куриного яйца и многим другим увеличивается значение бытовых, клещевых и пыльцевых аллергенов. К особой группе причинных факторов атопического дерматита относят бактериальные, грибковые, лекарственные, вакцинальные и другие аллергены. Однако они реже встречаются как самостоятельно значимые причинные факторы и обычно выступают в комплексе с другими аллергенами, чаще всего выполняя роль триггеров – факторов, имеющих преимущественно провоцирующее действие за счет усиления отдельных звеньев аллергических реакций (табл. 18). Таблица 18 Варианты сенсибилизации при атопическом дерматите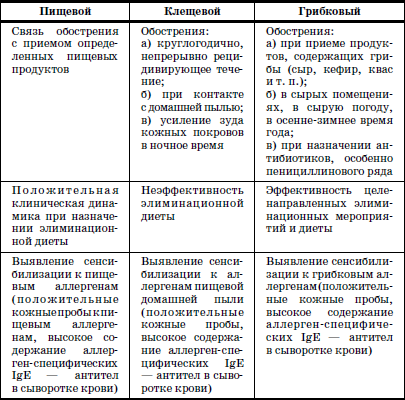 Обострение атопического дерматита способны вызвать самые различные факторы: психоэмоциональные нагрузки, изменение метеоситуации, табачный дым, нарушение правил ухода за кожей и др. Диагностика атопического дерматита основывается на анализе истории жизни ребенка, клинических симптомах поражения кожных покровов и аллергической предрасположенности, подтвержденной специальными методами исследования. Характерными признаками атопического дерматита являются: 1) начало заболевания в раннем детском возрасте; 2) наличие аллергических заболеваний у родителей и (или) у близких родственников; 3) зуд кожных покровов; 4) типичная картина кожных высыпаний: краснота, появление на этом фоне мокнущих пузырьков, узелков, сухости, трещин, шелушения и др. (табл. 19); 5) локализация кожных высыпаний в местах, характерных для каждого возрастного периода (на лице, ягодицах, сгибательных поверхностях конечностей и др.); 6) хроническое рецидивирующее течение болезни; 7) наличие характерных изменений лабораторных показателей. Атопический дерматит требует длительного комплексного лечения. Основные лечебные мероприятия следующие: • устранение или уменьшение воспалительных изменений кожи и кожного зуда; • восстановление структуры и функций кожи; • предотвращение развития тяжелых форм заболевания, приводящих к снижению качества жизни больного и инвалидизации; • лечение сопутствующих заболеваний, усугубляющих течение атопического дерматита. Таблица 19 Основные элементы кожных высыпаний при атопическом дерматите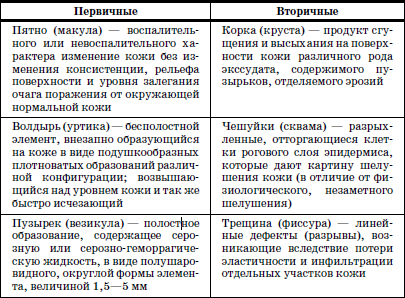  Лечение больных атопическим дерматитом складывается из диетотерапии и мероприятий по контролю окружающей среды (исключение причинно-значимых аллергенов), системной фармакотерапии, наружной терапии и реабилитации. Успех лечения определяется также устранением или уменьшением сопутствующих нарушений в органах и системах ребенка. Из рациона детей, страдающих атопическим дерматитом, исключают продукты, содержащие пищевые добавки (красители, консерванты, эмульгаторы), а также бульоны, острые, соленые, жареные блюда, копчености, пряности, консервированные продукты, печень, рыбу, икру, морепродукты, яйца, сыры острые и плавленые, мороженое, майонез, кетчуп, грибы, орехи, тугоплавкие жиры и маргарин, газированные фруктовые напитки, квас, кофе, какао, мед, шоколад, карамель, торты, кексы. При этом следует подчеркнуть, что практически любой пищевой продукт может вызвать аллергическую реакцию, в связи с чем исключение его из рациона питания должно осуществляться только при доказанной непереносимости. Здесь необходимо подчеркнуть, что выполнение ряда диетологических рекомендаций в доме ребенка весьма затруднительно, а некоторые упоминаемые продукты практически не используются в детских дошкольных учреждениях. Однако врачи должны располагать исчерпывающими сведениями о лечении детей: неожиданные нарушения питания могут возникнуть при организации праздников, посещений родственников и т. п. При лечении атопического дерматита назначают лекарственные средства, восстанавливающие функции органов пищеварения, антигистаминные, иммуномодулирующие и антибактериальные препараты, витамины, средства, регулирующие функциональное состояние нервной системы и др. Целый арсенал лекарств назначается при так называемой наружной терапии атопического дерматита. Специалисты подсчитали, что для лечения детей, страдающих им, может использоваться от 20 до 80 различных препаратов. Успех их применения обусловлен тем, насколько они отвечают индивидуальным особенностям детского организма, стадии болезни, условиям жизни ребенка и т. п. Показанием для назначения антигистаминных препаратов обычно служит обострение атопического дерматита и зуд кожных покровов. Антигистаминные препараты первого поколения (тавегил, супрастин, диазолин и др.) применяют в тех случаях, когда необходим не только противозудный, но и седативный эффект. Для длительного применения обычно выбирают антигистаминные препараты второго поколения (кларитин, кестин, зиртек и др.). Однако следует иметь в виду, что в настоящее время они не применяются у детей до 2-летнего возраста. Препаратом выбора для назначения детям раннего возраста является фенистил (диметинден). Он относительно редко дает побочные эффекты и обладает слабым седативным действием. При атопическом дерматите, осложненном пиодермией, врачи дома ребенка должны назначать антибактериальные препараты наружно (анилиновые красители, антисептики в растворах, мази банеоцин, бацитрацин, пиолизин, бактробан и др.), а в тяжелых случаях проводить системную антибактериальную терапию. При эмпирической терапии предпочтение отдается макролидам, цефалоспоринам I и II поколения, линкозамидам и аминогликозидам. Выраженный клинический эффект на стадии острого воспаления оказывают топические глюкокортикостероиды. Однако клинический опыт заставляет относиться к их назначению с большой осторожностью. Согласно рекомендациям Союза педиатров России общие правила назначения наружных глюкокортикостероидов сводятся к следующему. Препараты назначают только в острой и/или хронической фазах заболевания и не используют для профилактики атопического дерматита. Как правило, детям дают препараты с высокой эффективностью и безопасностью, обладающие пролонгированным действием. Начинают терапию с сильных глюкокортикостероидов (3–5 дней), затем (при необходимости) продолжают более слабыми топическими стероидами (до 2–3 недель). При этом предпочтение отдают коротким курсам, а не длительным непрерывным. Фторированные стероиды не назначают младенцам и детям первых лет жизни, их не накладывают на область лица, шеи, аногенитальную область. При присоединении вторичной инфекции назначаются местно или системно антибактериальные препараты, а уже затем глюкокортикостероиды. В педиатрической практике в настоящее время стремятся использовать глюкокортикостероидные препараты последнего (IV) поколения – адвантан (с 6-месячного возраста) и элоком (с 2-летнего возраста). Они обладают довольно высокой эффективностью и относительной безопасностью. Их используют только один раз в сутки, длительность курсового лечения составляет около 2 недель, но в большинстве случаев она ограничивается 3–5 днями. В настоящее время новым средством для лечения детей с атопическим дерматитом стал негормональный высокоэффективный препарат элидел (пимекролимус). Среди других противовоспалительных средств, традиционно используемых в лечении детей с атопическим дерматитом, следует упомянуть «классические» наружные средства, содержащие деготь, нафталан, окись цинка, дерматол, папаверин, АСД (III фракция) и др. Они хорошо переносятся детьми, их можно применять уже с первых месяцев жизни при легком и среднетяжелом течении болезни. В последние годы стремительно расширяется диапазон средств детской лечебной косметики для ухода за кожей детей, страдающих атопическим дерматитом. Для устранения сухости назначают ежедневные 20-минутные купания, после которых кожу ребенка не вытирают, а промокают мягким полотенцем. На сухие участки наносят смягчающие и питательные средства: бепантен (крем или лосьон), драполен, ирикар, радевит, детский крем и т. п. Чтобы исключить обострение болезни и облегчить течение хронического процесса, рекомендуется коротко стричь детям ногти (неухоженными ногтями малыши при кожном зуде быстро повреждают кожу), надо избегать горячих ванн и тщательно вытирать тело ребенка после водных процедур (промокая мягким полотенцем). При уходе за детьми, больными атопическим дерматитом, не следует пользоваться мылом (таким детям рекомендуются заменители мыла без щелочи), в помещении не допускать высокой температуры; дети не должны носить шерстяные вещи; их надо одевать в одежду из хлопчатобумажных тканей. В групповых комнатах и спальнях надо поддерживать относительную влажность около 40 %. Целесообразно убрать из помещения все возможные источники скопления пыли и плесени. В комнатах, где могут находиться дети, нельзя сушить одежду и постельное белье. Буфетные помещения следует оборудовать дополнительной вытяжкой. В качестве постельных принадлежностей рекомендуется использовать синтетические наполнители взамен перовых и пуховых изделий. Смену постельного белья следует осуществлять 1–2 раза в неделю и ежедневно просушивать. Необходимо отказаться от одежды на основе шерсти и меха животных. При обнаружении атопического дерматита у кого-либо из детей, воспитывающихся в доме ребенка, нельзя заводить в помещениях домашних животных, рыбок и птиц, надо исключить контакт больного с растениями, образующими пыльцу, отказаться от лечения экстрактами растений. ГЛАВА 5. Синдром внезапной смерти младенцев Согласно определению, принятому на II Международной конференции, посвященной проблемам детской смертности, под синдромом внезапной смерти младенцев или синдромом внезапном младенческой смерти (СВМС) понимают неожиданную, ненасильственную смерть ребенка грудного возраста, при которой отсутствуют адекватные для объяснения причин смерти клинические и патолого-анатомические признаки заболевания. Первые эпидемиологические исследования распространенности СВМС относятся к 60-м годам XX в. Однако только в 80-х были разработаны и приняты в большинстве стран критерии определения синдрома и протокол патолого-анатомического исследования случаев скоропостижной смерти детей раннего возраста. В конце 80-х в большинстве развитых стран от СВМС умирал 1 ребенок из 500 детей первого года жизни. После внедрения национальных программ профилактики СВМС смертность от этого синдрома существенно снизилась: в настоящее время – 1 ребенок на 1300 детей. Синдром внезапной смерти является одной из основных причин гибели детей в возрасте от 7 дней до года. Распространенность данного синдрома многие исследователи связывают с успехами последних десятилетий в области неонатологии по выхаживанию новорожденных, находящихся в критическом состоянии после рождения. При этом гибель ребенка первого года жизни, имеющего факторы риска, может реализоваться позже при воздействии триггерных факторов в виде синдрома внезапной смерти. В России на протяжении длительного времени этот синдром как причина смерти не регистрировался. С 1999 г. введена его регистрация в перечне причин смерти как отдельной рубрики. В соответствии с Медицинской классификацией болезней X пересмотра этот синдром обозначается как «внезапная смерть грудного ребенка» в разделе «Неизвестные причины смерти» под рубрикой R 95. Проблема гибели детей, воспитывающихся в домах ребенка, от СВМС имеет особую актуальность. Анализ смертности воспитанников домов ребенка (Служебное письмо МЗ РФ от 31.05.2000) выявил, что в 22,9 % случаев смерть детей наступила непосредственно в доме ребенка. Наряду с тяжелой врожденной патологией, ОРВИ и острой пневмонией, синдром внезапной смерти является одной из ведущих причин гибели детей, наступившей непосредственно в стенах интернатного учреждения (около 20 %). Обращает на себя внимание, что в 16,3 % случаев смерть детей наступила в отсутствие персонала. По данным медицинских документов умерших детей, в большинстве домов ребенка не проводилась экспертная оценка летальных случаев. Случаи неожиданной гибели клинически здорового ребенка первого года жизни известны давно. Долгие годы в повседневной практике бытовал термин «заспать ребенка». Считалось, что мать во сне удушает (неумышленно) спящего с ней в одной кровати ребенка. Предпринимались попытки, чаще всего далекие от медицинского подхода к решению проблемы, уберечь детей. Так, в 1732 г. в Италии была создана специальная камера, в которую помещали спящего ребенка. Позже случаи СВМС связывали с увеличением тимуса у грудных детей («тимическая смерть»), поскольку при патолого-анатомическом исследовании часто обнаруживалась тимомегалия. До сегодняшнего дня причины возникновения синдрома внезапной смерти остаются не до конца ясными. Вместе с тем установлены основные закономерности и факторы риска его развития. Известно, что чаще всего СВМС встречается у детей в возрасте 2–4 месяцев, высокий риск сохраняется до 6 месяцев и редко отмечается у детей старше 1 года (в России – 2 % всех случаев). Мальчики страдают в 1,5 раза чаще девочек. Наибольшее количество случаев регистрируется в холодное время года (осень-зима). Описана связь с неблагоприятными метеорологическими условиями. Наиболее опасными являются ночные и ранние утренние часы. Нередко СВМС развивается вскоре после перенесенной острой респираторной вирусной инфекции, а при аутопсии выявляются минимально выраженные проявления ОРВИ. Установлены факторы риска развития синдрома внезапной смерти: I. Социальные факторы – Вредные привычки родителей (особенно матери). – Неблагоприятные жилищно-бытовые условия. – Незарегистрированный брак. – Низкий образовательный уровень родителей. – Недостаточный уход и внимание к ребенку. – Неправильный уход (мягкая подушка, сон на животе, тугое пеленание и др.). II. Биологические факторы – Неожиданная смерть другого ребенка в семье. – Эпизоды очевидных жизнеугрожающих состояний, отмечаемых у ребенка в анамнезе. – Отягощенный акушерско-гинекологический анамнез матери (аборты, выкидыши, короткие промежутки между родами и др.). – Юный возраст матери. – Перинатальные факторы (хроническая внутриутробная гипоксия, недоношенность, задержки внутриутробного развития, внутриутробная инфекция, асфиксия новорожденного, синдром дыхательных расстройств и др.). – Искусственное вскармливание. – Недостаточная или избыточная прибавка массы тела, низкий рост, дисгармоничное развитие. – Атопический или лимфатико-гипопластический тип конституции. – Дефицит секреторного компонента IgA. – Вегетативная дисфункция. Учет факторов риска позволил выделить три основных группы риска по развитию CMC: – дети, имеющие низкую массу тела при рождении; – сибсы жертв СВМС (риск развития данного синдрома в 4–7 раз выше, чем в популяции); – дети, перенесшие очевидные жизнеугрожающие состояния (ОЖС). Выделение ОЖС в симптомокомплекс связано с фактом возникновения этого состояния у детей, погибших впоследствии от синдрома внезапной смерти. Клинически ОЖС представляет собой эпизод, характеризующийся комбинацией следующих признаков: апноэ, брадикардия, изменение цвета кожи (бледность или цианоз), мышечная гипотония и гипорефлексия, поперхивание. В 80 % случаев ОЖС возникает в период бодрствования детей. Установлено, что СВМС в значительной мере связан с пост-гипоксическими состояниями, морфо-функциональной незрелостью, задержкой внутриутробного развития. Это предопределяет незрелость регуляторных процессов, приводящую к нарушению основных функциональных систем ребенка. Следствием внутриутробной гипоксии являются нарушения регуляторных центров стволовой части мозга, что вызывает функциональную дезадаптацию ребенка. Определяющую роль в постановке диагноза СВМС играют результаты патолого-анатомического исследования. По мнению А.В. Цинзерлинга, детей, умерших от синдрома внезапной смерти, можно разделить на две группы: 1) дети с отсутствием каких-либо клинико-анатомических признаков жизнеугрожающих состояний; 2) дети с минимально выраженными клинико-анатомическими признаками ОРВИ. Результаты внешнего осмотра детей, погибших в результате СВМС, малоспецифичны. Однако среди фенотипических особенностей отмечается распространенность малых аномалий развития: признаки дизморфизма (грыжи, гидроцеле и др.) и диспластические изменения (гемантомы, невусы) встречаются в два раза чаще, чем в популяции. На секции, как правило, обнаруживаются признаки, являющиеся тканевыми маркерами хронической гипоксии: – избыточное развитие гладкой мускулатуры в артериях легких; – увеличение массы правого желудочка; – повышение уровня фетального гемоглобина в крови; – повышенный внекостномозговой гемопоэз; – увеличение размеров вилочковой железы; – гиперплазия хромаффинной ткани, в частности мозгового слоя надпочечников; – признаки дисфункции надпочечников с аденоматозными разрастаниями и кистами в дефинитивной коре и гигантскими клетками в фетальной зоне коры надпочечников, обилие бурого жира вокруг надпочечников; – снижение запасов катехоламинов в стволе головного мозга; – снижение активности допамин-?-гидроксилазы и повышение активности тирозингидроксилазы в гипоталамусе и хвостатом теле; – достоверное снижение количества миелинових волокон в шейном отделе спинного мозга; – глиоз ствола головного мозга и демиелинизация периферических нервных волокон; – отек и набухание головного мозга; – петехии в серозных оболочках; – сегментарный отек легких; – вздутый живот. Возможные механизмы СВМС до конца не изучены. В научной литературе выдвигаются различные гипотезы. Однако наиболее обоснованы на сегодняшний день две из них: 1) кардинальная (первичная остановка сердца, ведущая к вторичной смерти мозга); 2) респираторная (первичная остановка дыхания с последующей медленной остановкой сердца). Алгоритм, позволяющий разграничить вероятные механизмы СВМС представлен в табл. 20. Таблица 20 Патолого-анатомические признаки вероятных механизмов синдрома внезапной смерти (И.М. Воронцов с соавт., 1999)  При сумме балов «+13» и более – вероятна смерть в результате фибрилляции желудочков; при сумме «—13» и меньше – вероятная смерть в результате апноэ. Если пороговый уровень не достигнут, ответ неопределенный. Согласно современным представлениям большое значение в генезе СВМС играет незрелость нервной системы ребенка первых месяцев жизни. Следствием несовершенства регулирующей функции центральной и вегетативной нервной системы может явиться нарушение дыхательной и сердечной деятельности. Кардиальная гипотеза синдрома внезапной смерти сформировалась в конце 60-х годов. На сегодняшний день она является наиболее обоснованной, так как признаки электрической нестабильности миокарда часто обнаруживаются у детей, перенесших ОЖС и погибших в дальнейшем от СВМС. Кроме того, при патолого-анатомическом исследовании в 27 % случаев обнаруживаются посмертные признаки фибрилляции желудочков (М.А. Школьникова). Реализации кардиальных механизмов способствуют особенности сердечной деятельности детей первого года жизни: при электрокардиографическом исследовании выявляются признаки электрической нестабильности, увеличение QT-интервала, которое достигает максимума в возрасте 2–4 месяцев (пик смертности от СВМС!). Этому способствует нарушение вегетативной регуляции сердца (прежде всего симпатической). Кроме того, известно, что для детей первого года жизни характерно преобладание REM (быстрого) сна в структуре сна. Во время быстрого сна наблюдаются вспышки симпатической и вагальной активности, что приводит к увеличению QT-интервала. Незрелость вегетативной регуляции наиболее характерна для недоношенных, маловесных, функционально незрелых детей. С этих позиций чрезвычайно важной является правильная организация сна детей, исключающая возможность шума, включение яркого света, появление резких запахов и т. п. в помещении, где спят дети, поскольку эти факторы увеличивают риск возникновения электрической нестабильности миокарда. Маркерами дисбаланса между симпатическим и парасимпатическим отделами вегетативной нервной системы являются высокая частота сердечных сокращений, снижение вариабельности сердечного ритма и чувствительность барорецепторов. Следует подчеркнуть, что исследование вегетативного статуса воспитанников домов ребенка, проведенное на кафедре поликлинической педиатрии РМАПО, выявило, что сбалансированное состояние вегетативной регуляции имеется лишь у 6 % детей, у 75 % отмечена гиперсимпатикотония. В достаточной мере обоснованной является также «респираторная» гипотеза. Для детей первого года жизни в период быстрого (REM) сна характерны респираторные паузы и периодическое дыхание. Патологическим является апноэ, продолжительность которого более 20 с, а также более короткая респираторная пауза, если она сопровождается брадикардией, цианозом или бледностью, мышечной гипотонией. Периодическое дыхание не должно превышать 5 % от общей продолжительности сна. При неблагоприятных условиях оно может трансформироваться в апноэ. Следует отметить, что респираторная пауза, сопровождающаяся нарушением состояния ребенка, является наиболее очевидным предвестником синдрома внезапной смерти (абортивной СВМС) и требует немедленного оказания помощи ребенку. В дальнейшем необходима консультация специалиста и проведение динамического наблюдения за ребенком с применением дыхательного мониторинга. В научной литературе обсуждаются и другие гипотезы о возможной связи СВМС с различными биохимическими изменениями в организме ребенка. Так, высказывается предположение о связи данного синдрома с нарушением процесса (3-окисления жирных кислот (J.P. Награу). Наиболее явное последствие этого нарушения – приступы гипокетонемии и гипогликемии. Они могут развиваться на фоне кажущегося благополучия при воздействии таких провоцирующих факторов, как голодание ребенка, повышение температуры, инфекционные заболевания и пр. Приступ развивается быстро и может привести к гибели ребенка. Эту гипотезу подтверждает факт частого обнаружения у детей, погибших от СВМС, признаков жировой дистрофии печени, миокарда, скелетных мышц. Кроме того, в 17 % случаев у детей, имевших эпизоды ОЖС, выявлен дефект (3-окисления жирных кислот. Существует гипотеза о связи СВМС с нарушениями обмена липопротеидов и витамина Е. Дефицит витамина Е приводит к образованию в организме ребенка избыточного количества перекисных радикалов, нарушению функции печени. Кроме того, повышается сосудистая проницаемость, возникает дыхательная дисфункция, что проявляется обильной транссудацией, пенистыми, сукровичными выделениями из носа. Накопление перекисных радикалов может способствовать гиперплазии мышечного слоя сосудов. Подобные находки нередки при патолого-анатомическом исследовании детей, умерших от СВМС. Имеется гипотеза о связи СВМС с дефицитом магния (J.K. Miller), нарушением синтеза нейромедиаторов и гормоноподобных пептидов. Было выявлено значительное снижение активности катехоламинсинтезирующих ферментов. Участи детей, погибших от СВМС, выявлена низкая концентрация антагониста эндогенных эндорфинов (субстанции Р). Остановка дыхания у них могла быть вызвана избытком эндогенных наркотических веществ – эндорфинов. Интересна (с позиций общей профилактики СВМС) гипотеза, связывающая СВМС с «рефлексом паралича страха». «Паралич страха» – это атавистический рефлекс, ответ на чрезмерную внешнюю опасность. Он проявляется продолжительной иммобилизацией, снижением мышечного тонуса, остановкой дыхания на вдохе, брадикардией, периферической вазоконстрикцией. У детей первых месяцев жизни, воспитывающихся в доме ребенка, развитие подобного рефлекса могут спровоцировать разнообразные ситуации, связанные с несоблюдением персоналом правил ухода и воспитания. Ограничение движений (при тугом пеленании); отсутствие поддержки (подбрасывание ребенка вверх при общении с ним); боль (медицинские манипуляции); резкие незнакомые звуки; внезапное наступление тишины, резкое изменение освещенности и т. п. могут выступить в качестве провоцирующих факторов развития СВМС. Реакция усиливается, если воздействие фактора происходит во время засыпания. При этом тугое пеленание и ограничение движений ребенка во сне усиливают эффект резких звуков. Показано, что резкое звуковое раздражение во сне вызывают брадикардию, нерегулярное дыхание, трансформирующееся в апноэ. Профилактика СВМС в доме ребенкаПрофилактика СВМС должна охватывать всех детей первого года жизни, поступивших на воспитание в дом ребенка. Профилактическая работа осуществляется в трех направлениях: 1) предупреждение нарушений в уходе за новорожденными и детьми первых месяцев жизни; 2) выявление детей группы риска развития СВМС, проведение превентивной терапии; 3) мониторинг респираторной и сердечной деятельности у детей из группы риска развития СВМС. С целью выявления детей, относящихся к группе риска развития СВМС, всем новорожденным показано проведение оценки факторов риска (табл. 21). Таблица 21 Факторы риска развития синдрома внезапной смерти (по М.А. Школьниковой)  Если оценка риска не была проведена на предшествующих этапах выхаживания ребенка, ее проводят при поступлении малыша в дом ребенка. При выявлении суммы баллов более 70 он относится к группе риска СВМС и требует диспансерного наблюдения[2]: 1) ежемесячные осмотры с обязательной оценкой динамики длины и массы тела; 2) коррекция отклонений в состоянии здоровья (рахит, анемия, гипотрофия и др.); 3) медицинский отвод от профилактических прививок на 6 месяцев; 4) наблюдение невропатолога не реже 1 раза в 6 месяцев; 5) консультация кардиолога и регистрация ЭКГ – 1 раз в 2 месяца, проведение ЭХО КГ в возрасте 1 месяца; 6) консультация в специализированном центре. При сумме более 100 баллов ребенок относится к группе высокого риска по развитию СВМС. В этом случае показана постановка на учет в специализированном кардиологическом центре. Особое внимание должно уделяться воспитанникам домов ребенка, перенесшим очевидные жизнеугрожающие состояния, недоношенным и имеющим при рождении массу менее 2000 г, детям с признаками морфофункциональной незрелости при нормальных параметрах физического развития. Эффективным способом профилактики СВМС является строгое соблюдение рекомендаций по уходу за детьми первого года жизни. – Ребенок должен спать на спине на плотном матрасе, без подушки. – Нельзя оставлять ребенка одного во время сна – как дневного, так и ночного. – Необходимо избегать воздействия на ребенка во время сна (в том числе дневного) резких звуков, световых раздражителей, запахов. – Поддерживать температурный комфорт – не перегревать и не переохлаждать ребенка. – Избегать тугого пеленания. – В отсутствие грудного вскармливания молочное питание осуществлять современными адаптированными молочными смесями, обогащенными таурином, карнетином, витаминами, минеральными веществами и т. д. Учитывая известные закономерности развития СВМС, повышенного внимания требуют дети, болеющие ОРВИ и недавно перенесшие вирусную инфекцию. В течение заболевания и в период реконваленсценции целесообразно обеспечить тщательное наблюдение воспитателей и медицинского персонала за ребенком в период сна. При возникновении жизнеугрожающих состояний необходимо оказать ему неотложную помощь с последующей госпитализаей, обеспечить свободное носовое дыхание и увлажнение воздуха в помещении изолятора или группы, где он пребывает. Серьезную проблему могут представлять рефлюкс-ассоциированные апноэ, выявляемые у некоторых детей с эпизодами ОЖС (И.М. Воронцов). В этом случае меры, направленные на лечение гастроэзофагеального рефлюкса у детей с исходно высоким риском СВМС, выступают в качестве профилактики развития синдрома. В последнее время большое внимание уделяется мониторингу респираторной и сердечной деятельности (Информационное письмо МЗ РФ «О методах профилактики синдрома внезапной смерти детей первого года жизни» от 05.03.04). Это исследование позволяет выявлять развитие жизнеугрожающих тахиаритмий и респираторную дисфункцию как потенциальную угрозу СВМС и делает возможным проведение дифференцированной превентивной терапии. В условиях стационара для этих целей используются полифункциональные медицинские мониторы, позволяющие регистрировать кардиореспираторные нарушения. В условиях дома ребенка целесообразно проведение непрерывного мониторинга дыхательного ритма у детей группы риска в период сна в течение первых 4–6 месяцев жизни. Кроме того, следует проводить мониторинг дыхания во время сна у детей первого года жизни с признаками ОРВИ и в период реконвалесценции, поскольку этот период опасен с точки зрения развития СВМС. Для мониторинга дыхательной функции в доме ребенка могут быть использованы современные приборы, предназначенные для регистрации респираторной паузы большой продолжительности у новорожденных и детей раннего возраста. Таким образом, в случае тяжелого апноэ, при возникновении необходимости в реанимационных мероприятиях неотложная помощь может быть оказана в кратчайшие сроки. Медикаментозная превентивная терапия является важнейшей составляющей профилактики СВМС. Она включает: – нейрометаболическую терапию (глютаминовая кислота, ноотропил, аминалон, глицин и др.); – применение витаминов-антиоксидантов (витамины А, С, Е) и микроэлементов (селен); – применение карнитина хлорида (ЭЛЬКАР) и рибофлавина, чередуя их на протяжении всего первого года жизни. Применение кардиореспиторного мониторинга позволяет выявить наиболее вероятные механизмы (кардиальные или респираторные) в случае развития СВМС у конкретного ребенка из группы риска и проводить целенаправленною профилактику. ГЛАВА 6. Диагностика психических расстройств у детей раннего возраста Изучению психических расстройств в раннем детстве сопутствует немало трудностей. Они связаны прежде всего с тем, что для психических расстройств в данном возрасте характерны: – малая психопатологическая дифференцированность, обусловленная незрелостью морфофункциональных систем мозга; – выраженная изменчивость; – преобладание соматовегетативных и двигательных нарушений; – фактическое отсутствие у ребенка осознания и переживания своего нездоровья. Описать свои субъективные ощущения и точно выразить переживания может не всякий взрослый человек, даже принимая во внимание то, что он, как правило, способен хотя бы минимально проанализировать свое состояние. У ребенка же в возрасте до 3 лет еще не сформировалась внутренняя речь. Он может лишь почувствовать внутренний дискомфорт и выразить свои ощущения плачем и фразами типа «Мне плохо!» Среди особенностей психопатолологии раннего детского возраста следует отметить также мозаичность клинической картины, обусловленную сочетанием психопатологических симптомов с различными особенностями нарушений психического развития (акселерация, ретардация, диссоциация) и транзиторностью (В.В. Ковалев, Н.В. Римашевская, Г.В. Козловская). Значительный вклад в понимание сущности психических расстройств у детей раннего возраста внесло учение В.В. Ковалева об уровнях преимущественного нервно-психического реагирования ребенка на различные вредности. Всего таких уровней четыре, схематически можно выделить следующие: 1) соматовегетативный (соматовегетативно-инстинктивный) (0–3 года); 2) психомоторный (4-10 лет); 3) аффективный (7-12 лет); 4) эмоционально-идеаторный (12–16 лет). При этом каждый последующий уровень не исключает признаков предыдущего, однако эти признаки выражены заметно слабее. Онтогенетически наиболее ранним является соматовегетативно-инстинктивный уровень, для которого характерны различные варианты так называемого невропатического синдрома (повышенная общая и вегетативная возбудимость, склонность к расстройствам пищеварения, питания, сна, навыков опрятности и др.). Выделение этого уровня продиктовано тем, что в данный возрастной период лучше всего сформирована вегетативная регуляция организма. Это означает, что самые различные психические расстройства в раннем возрасте, будь то невроз, резидуально-органическое расстройство или даже шизофрения, будут сопровождаться прежде всего подобной симптоматикой, и на таком уровне происходит реакция организма. Поэтому невроз у ребенка раннего возраста будет иметь особый характер: на первый план выйдут именно соматовегетативные признаки, перечисленные выше. И это понятно, поскольку в таком возрасте у ребенка не сформирована внутренняя речь, он совершенно не отдает себе отчета в том, что происходит. Следовательно, нарушения сна и аппетита в раннем возрасте являются рудиментами, или прообразами, «зрелого» невроза. Еще раз отметим, что преимущественность того или иного уровня нервно-психического реагирования означает, что на каждом последующем уровне предыдущий не исчезает, а как бы отступает на задний план. На передний выходят расстройства более высокого уровня нервно-психического реагирования. То есть у взрослого пациента при невротических расстройствах сна и аппетита также будут фигурировать в клинической картине заболевания, но ведущее место займут нарушения идеаторного уровня. Исходя из вышесказанного, часто невротическое или неврозоподобное (напоминающее «чистый», стрессогенный невроз, но в основе своей имеющее, как правило, остаточные явления раннего органического поражения ЦНС перинатального гене-за) расстройство как бы маскируется соматической патологией, допустим, более частым возникновением ОРЗ. Поэтому, если специалист неправильно установит диагноз, будет назначено лечение, нацеленное исключительно на респираторное заболевание, в то время как к такой терапии обязательно должны «подключаться» седативные средства. Ситуация неправильной диагностики и назначения неправомерного лечения достаточно часта, поэтому персонал домов ребенка должен быть знаком с особенностями раннего онтогенеза и психических расстройств в этот период. Следовательно, этап диагностики в микропсихиатрии является крайне важным, особенно учитывая вышеперечисленные особенности раннего возраста, когда часто происходит как бы «мимикрия» одних расстройств под другие. От правильности оценки состояния напрямую зависит адекватность терапии психических нарушений 1. Факторы риска формирования психических расстройств у детей раннего возраста Такими факторами риска являются: 1) психические заболевания у одного или обоих родителей; 2) патологии беременности, в том числе токсикозы беременности, нефропатия, эклампсия, угроза выкидыша, внутриутробная гипотрофия, переношенная беременность и др.; 3) инфекционные заболевания в период беременности; лекарственные интоксикации, в том числе вследствие употребления психотропных препаратов; 4) употребление алкоголя и наркотиков, табакокурение в период беременности; 5) материнские стрессы различного генеза в период беременности; 6) патологии родов, в том числе кесарево сечение, затяжные или стремительные роды, использование ручного пособия, щипцов, вакуум-экстрактора; 7) наличие врожденных заболеваний, в том числе вследствие поражения генетического материала, например синдрома Дауна (часто приводящего к формированию выраженной умственной отсталости и нередко к развитию психопатоподобного синдрома), фенилкитонурии (при которой в случае несвоевременной диагностики и лечения также часто развивается выраженная умственная отсталость); 8) позднее прикладывание ребенка к груди; 9) отказ от ребенка; 10) тяжелые нейроинфекции в раннем постнатальном периоде; 11) серьезные психические травмы в раннем постнатальном периоде; 12) конфликты в семье, развод родителей; 13) смерть родителей; 14) неправильные методы воспитания, в том числе отвергающее, враждебное отношение к ребенку; 15) низкий социальный уровень семьи; 16) большая семья (больше 4–5 детей), в том числе из-за возникновения сиблингового соперничества. Основные индикаторы серьезной психопатологии и проявления психопатологии1) Отклонения в системе мать-дитя, в частности в виде «выкручивания» младенца из материнских объятий, отказа от кормления, укусов в грудь, агрессии по отношении к матери; 2) отсутствие страха посторонних, отсутствие чувства края, высоты; 3) феномен «ухода в себя»; 4) позднее начало гуления, молчаливость, отсутствие лепета, некоммуникативный характер речи; 5) отсутствие или искажение «комплекса оживления», отсутствие смены настроения, бедность мимики, обеднение эмоциональных контактов; 6) неправильное использование личных местоимений, затруднения в идентификации пола; 7) перевоплощения, утратившие игровой характер; 8) отсутствие понимания разницы между одушевленными и неодушевленными предметами (протодиакризис); 9) наличие психических автоматизмов («волшебник во рту, который говорит моим голосом»); 10) своеобразные страхи («тетя оторвет мою голову и выбросит на помойку»); 11) немотивированная агрессия по отношению к детям и персоналу; 12) аутоагрессия с нанесением повреждений; 13) преднамеренное стойкое деструктивное поведение. В последние годы возросло число так называемых пограничных расстройств, прежде всего невротического уровня. По данным Г.В. Козловской, их распространенность среди популяции детей раннего возраста составляет 6,9 %, а экстенсивность во всей психопатологии – 71 %. Соответственно, этим расстройствам уделяется наибольшее внимание. Невротические расстройства: Астеновегетативный синдром: • нарушения сна и аппетита; • капризность; • раздражительность; • запоры или поносы; • иногда нарушения терморегуляции. Анаклитическая депрессия. Специфическое расстройство при разлуке с матерью, протекающее в два этапа: сначала – протестная реакция, затем – адинамия, анорексия, безразличие к окружающему, вплоть до необратимой остановки в развитии. Невротическая депрессия. Возникает в условиях эмоциональной депривации и проявляется в виде: • плаксивости; • капризности; • нарушения сна; • анорексии или булимии; • иногда – регресс поведения и утрата ранее приобретенных навыков. Навязчивости: • сосание кулачка, тряпочек, белья; • моргание; • разнообразные раскачивания; • простые ритуальные действия на втором и третьем году (рудименты «взрослых» ритуалов: постукивания определенное число раз, повторение определенных фраз и др.). Истериформные проявления: • крики; • визжание; • бурные рыдания с падением на пол. Все это делается для привлечения внимания и достижения желаемого. Страхи. Возникают после падений, неожиданных и громких звуков, появления незнакомых людей и животных, окатывания водой, устрашающих рассказов, угроз, скандалов, запугиваний. Ночные страхи: • приступообразность; • возникновение чаще в просоночном состояния; • аффект страха сопровождается двигательным возбуждением по типу оборонительных движений, галлюцинациями, являющимися продолжением сновидений. Аффективно-респираторные приступы: • возникают у детей в возрасте от 7 месяцев до 3–4 лет; • возникают в связи с отрицательными эмоциями во время бурного плача; • кратковременное (несколько секунд) состояние; – тоническое напряжение мышц; – запрокидывание головы; – остановка дыхания; – побледнение, затем легкий цианоз лица. Следует отметить, что в этиологии невротических расстройств в раннем возрасте биологические факторы составляют больший удельный вес по сравнению с более старшими возрастными группами. Это означает, что невротические расстройства очень часто возникают на фоне резидуальной (остаточной) органической симптоматики, которой свойственны, с одной стороны, малая дифференцированность, диффузность, элементарность клинических проявлений, с другой – достаточное разнообразие и полиморфизм клинических форм невротического реагирования. Нарушения сна могут проявляться разнообразными расстройствами ритма сон – бодрствование в виде характерной его дизритмии или инверсии, нарушения этапов засыпания и пробуждения с длительными просоночными состояниями, возможным неузнаванием и отверганием близких людей, что может сочетаться с протопатическими (недифференцированными) ощущениями страха и нарушениями сознания. Но типичными для младенчества и раннего возраста являются изменения глубины сна: поверхностный сон с частыми пробуждениями, разнообразные двигательные стереотипии во сне, например, яктация, качание головой и туловищем, сон в определенной позе («на корточках»), сосание, вздрагивание во сне и др. Все эти нарушения возможны уже с первых месяцев жизни. К расстройствам сна относятся и так называемые младенческие крики (ночные и дневные крики во сне). Они не прекращаются ни на руках у взрослых, ни при пеленании и укладывании и сопровождаются хаотическими движениями. У детей постарше (7–8 месяцев) младенческий крик является компонентом просоночных состояний с агрессивными проявлениями, неузнаванием близких, фобическими реакциями (страхами) и иногда сопровождаются рвотой. При длительном сохранении нарушений сна по типу младенческих криков наблюдаются расстройства аппетита, пищеварения, снижение массы тела и др. Этиология младенческих криков неизвестна: они возникают сразу после родового стресса, а позже – в ответ на неспецифические факторы стресса: прививки, разлуку с матерью и даже в ответ на внезапное изменение внешнего вида матери или воспитателя (прически, яркого платья и т. д.). Иногда отмечается приступообразное течение младенческих криков по 2–3 недели. Среди нарушений системы сон – бодрствование заметное место занимает так называемый ритуальный отход ко сну у детей первых двух лет жизни. Ритуалы имеют вид привычных действий – сосание соски, пальца, подушки или выдергивание ниток из одеяла, царапанье головы, жевание бумаги, держание в руках определенного предмета – сухой веточки, кусочка обоев и др. Можно обозначить следующие формы нарушения сна: • нарушения засыпания (вследствие тревоги, страхов, галлюцинаторных переживаний, нередко сопровождаются патологическими привычными действиями, в том числе в виде сосания пальца или края одеяла, выдергивания волос); • укорочение продолжительности сна (быстрое засыпание, глубокий сон, пробуждение ночью, невозможность уснуть и отсутствие желания спать); • извращение ритма сна (бодрствование день за днем в ночные часы и сонливость днем); • поверхностный сон (не сон, а скорее дрема; нередко как бы переплетение сна и бодрствования); • прерывистый сон (одно или несколько ночных пробуждений с последующим через некоторое время новым засыпанием; дети могут оставаться спокойными, играть пальцами, одеялом, тихо напевать); • ранние пробуждения (резкое нарушение глубины сна в предутренние и утренние часы с полным или частичным пробуждением, при этом засыпание и глубина сна не нарушаются). В раннем возрасте проявляются также двигательные и психомоторные феномены, что, по-видимому, связано с близкими сроками формирования и начала функционирования в онтогенезе соматовегетативных и двигательных систем (Е.И. Кририченко, Г.И. Бобылева, Ю.С. Шевченко). До двух лет чаще наблюдаются малодифференцированные двигательные расстройства в форме стереотипных статических и динамических феноменов, возникающих чаще ночью и сочетающихся с другой невротической и неврозоподобной симптоматикой (в виде своеобразных поз и движений при засыпании и во сне, раскачиваний, ползания по кровати). Есть точка зрения, что данные феномены носят адаптивный характер, представляя собой реакции саморегуляции при задержке или нарушении развития процессов синхронизации биоритма. В домах ребенка часто можно наблюдать такой феномен, как яктация, т. е. раскачивание тела или головы. Она может проявляться как в положении лежа, когда младенец качает головой на подушке из стороны в сторону. Или же ребенок стоит на четвереньках и раскачивает тело в передне-заднем направлении. При этом у него отмечается «отрешенное» выражение лица, «бессмысленный» взгляд, контакт с ним затруднен. Очевидно, данный феномен вызван бессознательным стремлением к достижению комфортного состояния. Будучи лишенным тактильного контакта с матерью, которая успокаивает ребенка и даже обеспечивает формирование биоритмов, раскачивая его на руках, малыш воссоздает такое состояние искусственно. В специальной литературе были описаны крайне тяжелые депрессивные состояния у детей первого года жизни, которые затем были названы анаклитической депрессией (развивающейся в результате разрыва «анаклинных» связей опоры зависимости от матери). В жизни нередко создавались такие ситуации, когда мать и ребенка внезапно разлучали, чаще всего в результате смерти матери. Малыша помещали в детский приют, и здесь у него развивалось такое состояние, когда он поначалу приходил в сильное возбуждение (ажитацию), много раздражался, плакал, кричал. Затем наступала «торпидная» фаза, или фаза заторможенности, когда он, напротив, становился ко всему безучастным, обездвиженным, гипомимичным (апатическая аутизация), нарушался сон, резко снижался аппетит, происходила существенная потеря веса. В дальнейшем замедлялось формирование психических и моторных функций, появлялась склонность к диспепсиям, экземе, респираторным заболеваниям. Анаклитическая депрессия развивалась у детей со сформировавшейся привязанностью к матерям, которые некоторое время кормили их грудью. Если же ребенок был разлучен с матерью практически с самого рождения, то симптоматика имела место в значительно более мягкой форме. Когда ребенка удавалось воссоединить с матерью или создать ему альтернативную семью, эти проявления редуцировались, в противном случае развивался типичный синдром госпитализма со стойким эмоциональным и интеллектуальным регрессом. В наиболее тяжелых случаях, описанных в годы войны в классических работах Spitz и Goldfarb, анаклитическая (младенческая) депрессия могла привести к смерти ребенка. Без знания подобных состояний специалисты дома ребенка могут «принять» анаклитическую депрессию в торпидной фазе за «чистую» задержку психического развития или же за умственную отсталость. Неправильно может быть расценено и снижение иммунитета с частой заболеваемостью. Соответственно будет назначаться симптоматическое лечение без учета этиологических факторов возникновения данного расстройства. У детей в возрасте от 2 до 3,5 лет чаще отмечаются психомоторное беспокойство, нарушение внимания, импульсивно возникающие двигательные побуждения, отвлекаемость, нетерпеливость. Кроме того, наблюдаются состояния эмоционального возбуждения, реакций протеста и истероподобных приступов. Причем синдром двигательной расторможенности нередко сочетается с растормаживанием таких свойственных более раннему онтогенезу феноменов, как комплекс оживления, хождение и бегание на носочках, бег от препятствия к препятствию, бег по кругу, ползание на четвереньках. Поскольку у детей на этот период онтогенеза приходится активное формирование речевого аппарата, то при воздействии неблагоприятных психогенных факторов могут появляться патологические речевые феномены в виде запинок, заикания и мутизма (молчания). Диагностика аффективных (эмоциональных) расстройств, как и психопатологии в целом в раннем возрасте, затруднена вследствие отсутствия у детей самоотчета и несформированности самосознания. Весьма характерны страхи, которые могут иметь самое разнообразное содержание: боязнь громких или незнакомых звуков, посторонних людей, мытья головы, заводных игрушек и т. д. Чаще всего это конкретные, психологически объяснимые страхи. Надо заметить, что нет такого предмета, которого когда-либо не боялся бы ребенок. Практика показывает, что бояться можно абсолютно всего, достаточно возникнуть определенному условному рефлексу, негативной ассоциации с данным предметом. Однако в некоторых случаях они принимают чрезвычайно усиленную форму: дети начинают панически бояться знакомых вещей (игрушек, горшка, собственной кровати) или обычных манипуляций (купания, стрижки волос, ногтей). Иногда страхи сопровождаются общим двигательным беспокойством, в отдельных случаях – вегетативными реакциями: бледностью лица, потливостью головы, конечностей. На втором году жизни дети уже могут вербализовать страхи и иногда говорят, что боятся «волка», «Бабы Яги», «козы», «Деда Мороза». К трем годам страхи могут принимать рудиментарный бредовой характер («придет чужой – убьет»); в этом отношении настораживает, когда дети с хорошо развитой речью отказываются назвать свой страх и не ищут помощи у взрослых. В ряде случаев у них бывает безотчетный, неопределенный страх («у меня есть страх; он живет сверху; приходит, когда захочет, а прогнать его нельзя»). У детей раннего возраста встречаются так называемые фазные и биполярные аффективные расстройства (аналоги маниакально-депрессивного психоза по МКБ-Х). Это могут быть как биполярные, так и монополярные расстройства. Как известно, существует два вида фаз, или полюсов, – депрессивный и маниакальный. В монополярном варианте чаще всего проявляются депрессивные расстройства. Из эмоциональных расстройств депрессивного круга наиболее часто встречаются дистимии – перемежающиеся состояния капризности, недовольства, плача, нытья, которые в большинстве случаев сопровождаются избеганием взрослого. Дети раздраженно отталкивают от себя взрослых и даже в возрасте до 6 лет не успокаиваются у них на руках. Наиболее тяжело выглядят ажитированные депрессии, когда дети тянутся к воспитателю дома ребенка, но, не найдя успокоения, тут же отталкивают от себя. Иногда они почти совсем отказываются от еды, так что обслуживающий персонал пугается: вдруг они чем-то тяжело больны. Дети становятся малоподвижными, все делают с трудом, замедленно, часто вздыхают; не смеются, не плачут; выражение лица у них усталое, безразличное (что в общем резко контрастирует с обычной детской живостью). Невозможно в этот период адекватно оценить уровень развития таких детей, поскольку они не могут выполнить задания из-за замедления мыслительных процессов и ограничения концентрации привлеченного внимания. Из расстройств маниакального полюса уже в начале второго полугодия жизни отмечаются гипоманиакальные состояния. Без видимой причины вдруг появляется не характерный для данного ребенка (обычно гипомимичного и вялого) положительный эмоциональный полюс, сопровождающийся повышенной отвлекаемостью. Настроение таких детей весьма приподнято, они часто, порой совершенно неуместно улыбаются, «приплясывают», легко и незаметно переносят респираторные заболевания с высокой температурой тела. Такие состояния продолжаются, как правило, не более 2 месяцев. В раннем возрасте встречается и шизофрения, однако ее диагностика затруднена из-за чрезвычайной пластичности детской психики и ее очень быстрого развития. При этом становление психических функций может опережать формирование специфического шизофренического дефекта, что еще больше осложняет диагностику. Многие из психопатологических симптомов могут возникать и длиться не месяцы и годы, а недели и даже часы. Однако данный факт является скорее прогностически неблагоприятным. Как показали исследования детей из группы высокого риска по шизофрении, чем больше спонтанности в появлении психопатологических расстройств, чем глубже уровень так называемых «форпост-симптомов», чем сильнее и прогрессивнее развивается диссоциация (распад) психики, тем вероятнее развитие шизофренического процесса. Однако диагностика шизофрении в столь раннем возрасте представляет скорее академический интерес и не только нежелательна, но и является потенциально опасной. В этих случаях необходимо динамическое наблюдение за детьми из группы высокого риска по шизофрении и тщательный контроль симптоматики. В целом же для того, чтобы заподозрить у ребенка первых лет жизни шизофренический процесс, надо прежде всего: 1) иметь в виду отягощенную по шизофрении наследственность, особенно по обеим линиям (здесь уместен термин «шизотипическая» наследственность, так как имеются в виду не только клинически выраженные формы заболевания, но и патологические черты характера по типу шизоидной психопатии, «чудаковатость» и др.); 2) следует отметить и такое понятие, как шизотипический диатез, о котором подробнее скажем ниже; 3) насторожиться при появлении следующих признаков: – спонтанности в проявлении психопатологической симптоматики; – усложнения психопатологии и психотического уровня «форпост-симптомов»; – нарастания «расщепления», диссоциации психики или, как говорят, «дефекта». Иногда у детей раннего возраста отмечается так называемый шизотипический диатез. Он представляет собой психоневрологический симптомокомплекс, который отражает специфическое изменененное формирование психических функций у детей раннего возраста. Шизотипичность заключается в системной дефицитарности и диссоциированности (разобщенности) вегетативно-инстинктивной, эмоциональной, моторной икоммуникативной сфер. Шизотипический диатез является клиническим проявлением специфического шизотипического генотипа в раннем детском возрасте; характерен как для заболевших, так и для не заболевших детей из группы высокого риска по шизофрении; характеризуется следующими признаками: 1) дисгармонией психофизического развития, которая заключается в частичной задержке темпов созревания; 2) неравномерностью развития, которая заключается в отсутствии плавности перехода от одной ступени развития к другой с остановками развития, псевдозадержками; 3) диссоциацией развития, проявляющейся в диссинхронии («переслаивании», сосуществовании в каждой психической сфере разных по степени развития функций) или асинхронии (сосуществовании разных этапов развития в разных сферах психомоторики); 4) дефицитарностью психической организации в целом. 2. Меры профилактики психических нарушений и основные направления их лечения Изложенные материалы показывают, насколько важно принятие своевременных мер по предупреждению развития психических расстройств именно в раннем детстве. Для дома ребенка они важны особенно, поскольку дети здесь лишены главного фактора, который способствует нормальному развитию и психическому здоровью, – отношений в системе мать – дитя. Другими словами, в домах ребенка дети постоянно находятся в состоянии эмоциональной депривации. Меры первичной профилактики психических расстройств: • обеспечение ребенку максимально возможного эмоционального комфорта; • безусловное принятие ребенка как личности; • всестороннее развитие коммуникативной сферы, стимуляция формирования межличностного общения; • обеспечение условий для всестороннего развития ребенка (достаточное количество игрового материала, наличие необходимых пособий, создание обучающей среды и т. п.); • постоянное наблюдение психиатра, дефектолога и психолога; • проведение игровых занятий, позволяющих моделировать определенные жизненные ситуации. Основные направления в лечении детей раннего возраста с психическими расстройствами в условиях домов ребенка: 1) медикаментозная терапия; в зависимости от нозологической принадлежности расстройства это могут быть: • седативные препараты, в том числе из группы антидепрессантов, нейролептиков, транквилизаторов и гипнотиков; • ноотропные препараты; • препараты, улучшающие мозговое кровообращение; • нормотимики (препараты, «выравнивающие» настроение); • вегетотропные средства; • антиэпилептические средства; 2) психотерапия, в том числе игровая, поведенческая, когнитивная; 3) психолого-педагогическая коррекция имеющихся отклонений в развитии ребенка и личностных изменений; 4) профилактика рецидивов психических расстройств. ГЛАВА 7. Первая помощь при угрожающих состояних у детей на догоспитальном уровне Угрожающее неотложное состояние у детей – это состояние, при котором происходит декомпенсация жизненно важных функций организма ребенка (дыхания, кровообращения, нервной системы) или имеется непосредственная опасность ее возникновения. В зависимости от времени возникновения летального исхода Э.К. Цибулькин выделяет следующие группы угрожающих состояний: летальный исход возможен в течение 10 мин; летальный исход вероятен в течение нескольких часов или суток; возможен неблагоприятный исход или инвалидизация. Классификация угрожающих состояний в соответствии с экстренностью диагностики и начала лечебных мероприятий представлена в табл. 22. Таблица 22 Классификация угрожающих состояний 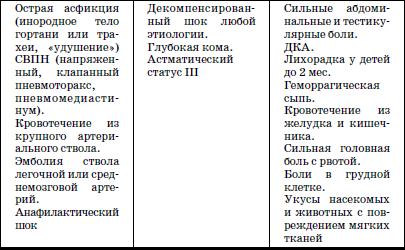 Различают следующие уровни оказания неотложной медицинской помощи: • доврачебный (оказывается средним медицинским персоналом); • общеврачебный (оказывается педиатрами, врачами общей практики); • квалифицированный (оказывается врачами-реаниматологами, имеющими рабочее место реаниматолога); • специализированный (оказывается врачами анестезиологами-реаниматологами в специализированных отделениях); • высококвалифицированный (оказывается в специализированных региональных центрах). В данном руководстве приводится краткое описание, даются схемы и алгоритмы оказания неотложной помощи на общеврачебном уровне при ряде угрожающих состояний, возникновение которых наиболее вероятно у воспитанников домов ребенка, а также основные мероприятия по оказанию догоспитальной помощи на доврачебном уровне. 1. Общеврачебный уровень оказания помощи при угрожающих состояниях[3] Общие принципы сердечно-легочной реанимации Фазы терминального состояния: предагония, агональное состояние, клиническая смерть. Основные признаки клинической смерти: потеря сознания, апноэ, отсутствие пульса на крупных артериях (сонной), цианоз или бледность кожных покровов, широкие зрачки, отсутствие реакции зрачков на свет. П. Сафар выделяет три фазы (ступени) сердечно-легочной реанимации: I. Основные мероприятия по поддержанию жизни. II. Дальнейшие мероприятия по поддержанию жизни. III.Мероприятия по длительному поддержанию жизни. На общеврачебном уровне проводятся мероприятия I фазы по поддержанию жизни. Последовательность трех важнейших приемов сердечно-легочной реанимации сформулированы в виде «правил АВС». Ступень A (Airways) – восстановление проходимости дыхательных путей, так как ребенок может погибнуть от аспирации содержимого желудка, попадающего в результате регургитации в дыхательные пути. Ступень В (Breathing) – обеспечение дыхания и оксигенации. При невозможности проводить оксигенацию осуществляют ИВЛ экспираторными методами («изо рта в рот» и «изо рта в нос»). Контроль-экскурсия грудной клетки, уменьшение степени цианоза. Ступень С (Circulation) – восстановление кровообращения. Закрытый массаж сердца проводится с частотой не менее 80-100 в минуту (в соответствии с возрастом ребенка). Компрессия осуществляется на у диаметра грудной клетки ребенка в покое. После смещения грудины вниз с целью увеличения сердечного выброса ее фиксируют в этом положении в течение 50 % времени цикла. У детей первого года жизни закрытый массаж сердца проводится одним пальцем, у детей до 8 лет – одной рукой. У детей до 8 лет соотношение вентиляции и компрессии 1:5; если помощь оказывают два человека, и 2:15, если один. Схема проведения сердечно-легочной реанимации представлена на схеме 1. Схема 1 Первичная сердечно-легочная реанимация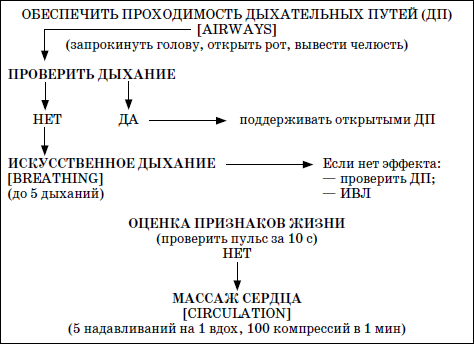 2. Острая дыхательная недостаточность Инородное тело верхних дыхательных путейОсновные клинические проявления: клиническая картина зависит от уровня обструкции. Чем ближе к гортани, тем вероятнее развитие асфиксии и терминального состояния. Общее беспокойство, кашель, приступ удушья, афония, резкий цианоз, инспираторная одышка. При неоказании своевременной помощи – отек легких. Если ребенок в сознании – необходимо не сдерживать кашель. Активное вмешательство предпринимают при ослаблении кашля, усилении стридора, при потере сознания: • осмотр ротовой полости и входа в гортань (лучше с помощью прямой ларингоскопии); • попытки удалить инородное тело: – ребенок в возрасте до 1 года – укладывают животом вниз, лицом на предплечье врача. Указательным и средним пальцем фиксируют голову и шею. Предплечье опускают вниз на 60°. Ребром ладони другой руки наносят 4 коротких удара между лопатками ребенка; – ребенок старше 1 года (первых лет жизни) – выполнить прием Геймлиха 5 раз (ребенка сажают на колени спиной к врачу, кисти рук врача перекрещиваются на его животе между талией и грудной клеткой, производят резкий толчок под углом 45° в сторону диафрагмы); • повторный осмотр полости рта и входа в гортань; • продолжать выполнять прием Геймлиха, пока не будет устранена обструкция или пока ребенок не потеряет сознание; • по мере углубления гипоксической комы и при терминальном состоянии ларингоспазм проходит и в большинстве случаев частично открывается просвет дыхательных путей. Это дает возможность проведения искусственного дыхания экспираторными методами (ИВЛ); • как можно раньше вызвать реанимационную бригаду. Стеноз гортаниСтеноз гортани I степени (компенсированный) Основные клинические проявления: при физической нагрузке или беспокойстве инспираторная одышка с вытяжением яремной ямки, охриплость голоса, проявлений дыхательной недостаточности нет. • Успокоить ребенка; • паровые ингаляции; • рефлекторно отвлекающая терапия (горячие ножные ванны); • инстилляция нафтизина 1 % раствор 3–4 капли в носовые ходы (детям старше года); • обильное теплое питье глюкозо-солевых растворов; • госпитализация в инфекционное отделение в положении сидя. Стеноз гортани II степени (субкомпенсированный) Основные клинические проявления: дыхание шумное, инспираторная одышка с участием вспомогательной мускулатуры в покое. Бледность, цианоз кожных покровов, тахикардия. Ребенок возбужден, беспокоен. • Проведение паровых ингаляций, рефлекторно отвлекающая терапия – горячие ножные ванны (до приезда «скорой помощи»); • инстилляция нафтизина 1 % раствор 3–4 капли в носовые ходы (детям старше года); • обильное теплое питье глюкозо-солевых растворов; • увлажнение вдыхаемого воздуха – распыление и медикаментозные ингаляции адреналина, который разводят изотоническим раствором в соотношении 1:7 и распыляют в течение 15 мин (2–4 мл) из струйного аэрозольного или в течение 3–5 мин из ультразвукового ингалятора (препарат замены – эфедрин, нафтизин); • внутримышечно: эфедрин 5 % 0,1 мл/год, преднизолон 2 мг/кг; • госпитализация в инфекционное отделение в положении сидя. Стеноз гортани III степени (декомпенсированный) Основные клинические проявления: дыхательная недостаточность III степени, редкое втяжение уступчивых мест грудной клетки, выраженная бледность кожных покровов, тахикардия, глухость сердечных тонов, парадоксальный пульс. В легких дыхание проводится плохо. Повышенная потливость, голос хриплый, грубый кашель. Беспокойство сменяется адинамией. Стеноз гортани IV степени (асфиксия) Основные клинические проявления: состояние крайне тяжелое, продолжает ухудшаться, развитие асфиксии, гибель ребенка. • Вызов бригады интенсивной терапии; • медикаметозные ингаляции нафтизином или адреналином; • внутримышечно эфедрин 5 % 0,1 мл/год; • внутривенно преднизолон 5 мг/кг; • оксигенотерапия. ЭпиглоттитОсновные клинические проявления: сильная боль в горле, выраженная дисфагия, гиперсаливация, быстрое нарастание симптомов стенозирования дыхательных путей. Выраженный токсикоз, гипертермия, тахикардия (иногда не соответствует степени лихорадки), беспокойство. Свистящее дыхание на вдохе, хрипы на выдохе. Ребенок сидит выпрямившись. При осмотре ротоглотки – темно-вишневая инфильтрация корня языка. • Антибиотики (левомицетин 50-100 мг/кг и др.); • оксигенотерапия; • транспортировка в инфекционное отделение только в положении сидя; • в случае развития стеноза III степени вызов бригады интенсивной терапии, поскольку возможно «неожиданное» закрытие входа в гортань. Ларингоспазм при спазмофилииОсновные клинические проявления: наличие признаков рахита у ребенка до 2 лет, повышенная нервно-мышечная возбудимость. При волнении, испуге, напряжении появляется затруднение вдоха, шумное дыхание. Возможно апноэ в течение нескольких секунд. Кожные покровы бледные, цианотичные, холодный пот. Приступ заканчивается шумным вдохом («петушиный крик»), дыхание постепенно нормализуется. При длительном спазме возможна потеря сознания. В течение дня возможно повторение ларингоспазма. • Рефлекторное снятие спазма: опрыскать лицо холодной водой; • внутривенно 10 % раствор кальция хлорида 1 мл/год; • госпитализация в соматическое отделение. 3. Острая сердечно-сосудистая недостаточность ОбморокОсновные клинические проявления: кратковременное нарушение сознания, возникающее в результате преходящей ишемии мозга. Характерно нарушение сознания, атония, расширение зрачков, отведение глазных яблок кверху, низкое артериальное давление, нитевидный пульс. Обмороку часто предшествует общая слабость, потемнение в глазах, шум в ушах, холодный пот, неприятные ощущения в эпигастральной области. • Обеспечить свободное дыхание и приток свежего воздуха; • возвышенное положение ног; • обрызгать лицо холодной водой и/или похлопать по щекам полотенцем, смоченным холодной водой; • дать вдохнуть пары нашатырного спирта; • растереть тело, обложить грелками; • по показаниям – кордиамин по 1 капле на год жизни через рот, при затянувшемся обмороке – внутримышечно кордиамин 0,1 мл/год или кофеин 10 % раствор по 0,1 мл/год, 1 % раствор мезатона 0,1 мл/год (не более 1 мл). При выраженной гипотонии и брадикардии – 0,1 % раствор атропина по 0,1 мл/год (не более 1 мл) внутримышечно или подкожно; • экстренная госпитализация в отделение интенсивной терапии или реанимации. При отсутствии эффекта: • вызов бригады интенсивной терапии; • непрямой массаж сердца. Синдром малого сердечного выбросаОсновные клинические проявления: наиболее часто наблюдается у детей раннего возраста, являясь последствием ОРВИ с токсикозом, инфекционных и инфекционно-аллергических миокардитов, нарушений электролитного обмена. Характерен болевой синдром, беспокойство ребенка, сменяющееся заторможенностью, падение АД, тахикардия, нитевидный пульс, бледность кожных покровов, акроцианоз, холодный пот, спадение периферических вен, олигоанурия. • Вызов бригады интенсивной терапии. Кардиогенный отек легкихОсновные клинические проявления: беспокойство, в последующем возможно нарушение сознания. Кожные покровы бледные, в последующем синюшные, холодный липкий пот. Дыхание клокочущее. Аускультативно – большое количество влажных мелко– и среднепузырчатых хрипов, возможна олигоанурия. • Положение с приподнятым головным концом; • лазикс 2–4 мг/кг внутривенно; • преднизолон 5-10 мг/кг; • оксигенация кислорода 40 % концентрации, пропускаемого через раствор 33 % спирта; • вызов бригады интенсивной терапии 4. Судорожный синдром Фебрильные судорогиОсновные клинические проявления: чаще наблюдаются у детей раннего и дошкольного возраста с нарушениями со стороны ЦНС. Возникают при температуре выше 38 °C. Характерны то-нико-клонические припадки длительностью от нескольких секунд до нескольких минут, утрата сознания. • Анальгин 50 %– 0,1 мл/год и димедрол 1 %– 0,05 мл/кг внутримышечно; • госпитализация в соматический стационар после купирования судорог. Аффективно-респираторные судорогиОсновные клинические проявления: характерны для детей раннего возраста с повышенной возбудимостью. В анамнезе отмечается неблагополучие в течении внутриутробного периода, наследственная предрасположенность к аффективно-респираторным судорогам. Во время плача ребенка развивается апноэ, цианоз, возможны генерализованные тонические или клонико-тонические судороги. • Рефлекторное восстановление дыхания, седативные препараты; • при развернутом клонико-тоническом припадке – дормикум или седуксен 0,3 мг/кг; • госпитализация в соматический стационар после купирования судорог. Гипокальциемические судорогиОсновные клинические проявления: обусловлены снижением ионизированного кальция крови (при рахите, интоксикации витамином D, дисфункции паращитовидных желез, при обезвоживании и т. п.). В скрытом периоде выявляются симптомы Маслова, Хвостека, Люста, Труссо. При «явной» спазмофилии – ларингоспазм, карпопедальные спазмы, напряжение мимических, жевательных, дыхательных мышц. • Раствор кальция глюконата 10 %-ный 1,0 мл/кг в двукратном разведении раствором глюкозы внутривенно, медленно; • госпитализация в соматический стационар после купирования приступа. Эпилептический синдромОсновные клинические проявления: характерен для детей с активно протекающими заболеваниями головного мозга (опухоли, аномалии головного мозга, сосудистые поражения, метаболические нарушения, нейроинфекции и др.). Свойственна повторяемость судорожных припадков. • При невозможности внутривенных манипуляций диазепам 0,3 мг/кг внутримышечно. • Для усиления эффекта диазепама за 2–3 мин до этого вводят пипольфен (при его отсутствии супрастин или димедрол). • Сразу после уменьшения или прекращения психомоторного возбуждения под влиянием диазепама (обычно через 10–15 мин) внутривенно (медленно!) вводят натрия оксибутират в дозе 50-100 мг/кг. Длительное купирование судорожного синдрома и психомоторного возбуждения при совместном введении натрия оксибутирата и диазепама: 90-120 мин. В последующие сроки их клинический эффект значительно снижается, что требует повторных введений и увеличения дозировки. • Если приступ не купируется, вызывают бригаду интенсивной терапии. 5. Острые аллергические реакции АнафилаксияОсновные клинические проявления: анафилаксия – угрожающий жизни синдром, при котором летальный исход возможен в течение первых минут (или десятков минут) после его развития. Клиническая картина разворачивается бурно, начинаясь с общего дискомфорта, затруднения дыхания, появления полиморфных сыпей. Развивается острая сосудистая недостаточность, возможен бронхообструктивный синдром, судороги, нарушение сознания, коронарная недостаточность. • Вызвать бригаду интенсивной терапии; • уложить больного горизонтально с приподнятыми ногами; • в мышцы дна полости рта или внутривенно раствор адреналина 0,1 %-ный – 0,2 мл/год и преднизолон 10 мг/кг; • при выраженном бронхоспазме выполнить ингаляции сальбутамола или внутривенно эуфиллин 6 мг/кг; • димедрол 1 %-ный – 0,05 мл/кг парентерально; • при парентеральном поступлении антигена обколоть место инъекции 0,5 %-ным новокаином с 0,1 %-ным адреналином в возрастной дозе. КрапивницаОсновные клинические проявления: интенсивный зуд кожи, сыпь, элементы сыпи плотные, горячие, локализуются на любом участке кожи или слизистых, различных размеров. При токсическом течении элементы сыпи сливаются, отграничиваясь от неповрежденной кожи багрово-синюшными краями. Отмечаются признаки нарушения периферического кровообращения. Общие симптомы: головная боль, недомогание, повышенная температура тела, артралгия, боли в животе, диспепсия. В тяжелых случаях – развитие сердечной недостаточности. • Очистительная клизма, введение энтеросорбентов (активированный уголь, смекта, энтеродез); • обильное щелочное питье из расчета 15–30 мл/кг (минеральная вода с добавлением 1–2%-ного раствора питьевой соды); • димедрол 1 %-ный раствор 0,05 мл/кг (в первые сутки парентерально, затем перорально); • ферментные препараты. При токсической форме крапивницы: • димедрол 1 %-ный раствор 0,05 мл/кг парентерально; • преднизолон 1–2 мг/кг внутримышечно; • госпитализация в соматический стационар. Отек КвинкеОсновные клинические проявления: ограниченный отек кожи и/или слизистых оболочек (лицо, кисти и стопы, слизистые оболочки полости рта, мягкое небо), сопровождающийся чувством распирания. В процесс могут вовлекаться мозговые оболочки. При локализации процесса на слизистой ЖКТ – боли в животе; при локализации отека на слизистой МПС – болезненное мочеиспускание, возможна острая задержка мочи. При отеке гортани – охриплость голоса, лающий кашель, одышка, стридорозное дыхание. • Очистительная клизма, введение энтеросорбентов (активированный уголь, смекта, энтеродез); • обильное щелочное питье из расчета 15–30 мл/кг (минеральная вода с добавлением 1–2%-ного раствора питьевой соды); • димедрол 1 %-ный раствор 0,05 мл/кг (в первые сутки парентерально, затем перорально); • при нарушении функции жизненно важных органов – преднизолон 2 мг/кг парентерально; • при развитии отека гортани – преднизолон 2 мг/кг парентерально и вызов бригады интенсивной терапии. Укусы членистоногих (пчел, ос)Основные клинические проявления: в месте укуса боль, жжение, зуд. Развивается отек, локальный лимфаденит. Возможна общая реакция: лихорадка, артралгия, полиадения, сыпь. У детей с отягощенным аллергологическим анамнезом возможно развитие анафилактического шока. • Удалить жало; • обработать место укуса; • наложить холод на место укуса. При общей реакции: • адреналин 0,1 %-ный – 0,1 мл/год; • димедрол 1 %-ный – 0,05 мл/кг. При развитии анафилактического шока: • наложить жгут выше места укуса; • вызвать бригаду интенсивной терапии; • уложить больного горизонтально; • в мышцы дна полости рта или внутривенно ввести 0,1 %-ный раствор адреналина – 0,2 мл/год и преднизолон 10 мг/кг. При выраженном бронхоспазме: • ингаляция сальбутамола или эуфиллина 6 мг/кг внутривенно, димедрол 1 %-ный – 0,05 мл/кг парентерально; • обколоть место укуса 0,5 %-ным новокаином с 0,1 %-ным адреналином. 6. Нарушение терморегуляции «Розовая» лихорадкаОсновные клинические проявления: кожные покровы гиперемированы, теплые, влажные. Поведение обычно не изменяется. При температуре свыше 38 °C и отсутствии фоновой патологии и предшествующих эпизодов судорог: • парацетамол 10 мг/кг через рот. При температуре тела выше 39 °C: • обтирание; • парацетамол 10 мг/кг через рот. При отсутствии эффекта внутримышечно: • анальгин 50 %-ный – до года 0,01 мл/год, старше года 0,1–0,15 мл/год жизни; • пипольфен 2,5 %-ный – до года 0,01 мл/кг, старше года 0,1–0,15 мл/год жизни; • папаверин 2 %-ный – до года 0,1–0,2 мл, старше года 0,2 мл/год жизни. «Бледная» лихорадкаОсновные клинические проявления: кожные покровы бледные, «мраморные», губы и ногтевые ложа цианотичны оттенком, конечности холодные. Выраженная тахикардия, одышка, бред, возможны судороги. При наличии признаков шока: • вызов бригады интенсивной терапии; • внутримышечно пипольфен 2,5 %-ный – 0,15 мл/год жизни и анальгин 50 %-ный – 0,1 мл/год жизни; • преднизолон 5 мг/кг. При отсутствии признаков шока: • внутримышечно анальгин 50 %-ный – до года 0,01 мл/кг, старше года 0,1–0,15 мл/год жизни; • пипольфен 2,5 %-ный – до года 0,01 мл/кг, старше года 0,1–0,15 мл/год жизни; • папаверин 2 %-ный – до года 0,1–0,2 мл, старше года 0,2 мл/год жизни; • растирание кожи; • госпитализация. В условиях проживания детей в доме ребенка первыми с проявлениями неотложных состояний у детей сталкиваются чаще всего воспитатели и медицинские сестры. Их осведомленность в вопросах экстренной доврачебной помощи в этих случаях может сыграть решающее значение для сохранения здоровья, а иногда и жизни ребенка. 7. Неотложная доврачебная помощь ребенку Повышение температурыБольного ребенка надо уложить в постель, создать для него благоприятные условия (покой, тишина, полумрак), поить сладким чаем, морсом, минеральной водой (без газа), так как если он много пьет, температура не представляет большой опасности. При ознобе следует согреть больного (горячая грелка к ногам, теплое одеяло и т. п.). При температуре ниже 39–39,5 °C ребенка можно раскрыть и обтереть влажным полотенцем (температура воды для обтирания 30–33 °C). Здоровым (до заболевания) детям старше 3 месяцев жаропонижающие средства (парацетамол, ибупрофен) назначают при температуре 39 °C. При более низкой температуре жаропонижающие средства назначают в исключительных случаях по назначению врача: 1) детям 2–3 месяцев жизни; 2) детям, у которых ранее отмечались фебрильные судороги; 3) детям с хроническими заболеваниями; 4) если повышенная температура тела сопровождается мышечными и головными болями. Жаропонижающие средства обычно не назначаются, если ребенок получает антибиотик. Сохранение температуры служит для врача сигналом его неэффективности и, как правило, является основанием для замены антибактериального препарата. В настоящее время детям не назначают ацетилсалициловую кислоту (аспирин), так как она может вызвать довольно тяжелые поражения печени и мозга. Из-за токсичности бутадиена и пирамидона их также не рекомендуется давать. И наконец, хорошо известный препарат – анальгин. Он опасен тем, что способен поражать кроветворную систему и часто снижает температуру до очень низких пределов. Поэтому его не рекомендуется давать детям. При лихорадочном состоянии могут появиться тревожные сигналы, когда необходима экстренная врачебная помощь: 1) подъем температуры выше 40 °C; 2) пестрая «мраморная» окраска кожи; 3) ощутимое охлаждение конечностей. СудорогиРебенка необходимо положить на бок, при этом голову осторожно отводят назад, чтобы облегчить дыхание. Не надо насильно разжимать челюсти, чтобы не травмировать зубы или десны и из-за опасности аспирации. При повторных судорогах следует предупредить «неожиданные» падения и ушибы. При так называемых фебрильных судорогах, вызванных высокой температурой, ребенка необходимо раздеть и обтереть влажным полотенцем. До прихода врача можно дать одну дозу парацетамола. При возникновении судорог у него могут появиться тревожные сигналы, свидетельствующие о необходимости экстренной врачебной помощи: 1) появляется рвота и ребенок заглатывает рвотные массы; 2) происходит остановка дыхания; 3) судороги продолжаются более 15 мин или появляются вновь. При рвоте рот очищают пальцем, обернутым стерильной марлей, от оставшихся рвотных масс. При остановке дыхания проводят искусственное дыхание при помощи специальных устройств или по методике «изо рта в рот». Инородное тело дыхательных путейЕсли при попадании инородного тела ребенок стал энергично кашлять, можно попробовать в момент кашля ударить его по спине. Грудного ребенка держат за ноги «вниз головой» и быстро ударяют 4 раза между лопатками кистью руки. После этого малыша кладут на спину и 4 раза быстро надавливают на грудную клетку двумя пальцами на глубину 1,5–2,5 см. Если инородное тело становится видимым во рту, его удаляют; если этого не происходит, всю процедуру повторяют несколько раз. У более старших детей удары по спине чередуют с резким сдавливанием живота. Этот прием взрослый проводит, находясь сзади ребенка. Экстренная медицинская помощь и госпитализация требуются при появлении следующих тревожных признаков: 1) ребенок «неожиданно» начинает «давиться», у него перехватывает и останавливается дыхание; 2) инородное тело не удается извлечь в течение 1–2 минут; 3) кожа приобретает синюшный оттенок. НасморкПри насморке нос промывают 1 %-ным раствором поваренной соли или физиологическим раствором. В первые дни, когда из носа появляются обильные жидкие выделения, 3–4 раза в день закапывают сосудосуживающие препараты (отревин, називин, галазолин, нафтизин, санорин). Эти лекарства лучше всего закапывать ребенку, когда он лежит на спине со свешенной вниз головой. Воспаление среднего ухаГрудного ребенка следует уложить достаточно высоко и поставить на ухо согревающий компресс. Его делают следующим образом: бинт или марлю складывают в 4–6 раз, смачивают водкой или теплой водой, затем, надрезав посередине, надевают его на ушную раковину. Сверху накрывают полиэтиленовой пленкой чуть большего размера и ватой. Все это сооружение завязывают бинтом или платком. Старшим детям обычно не требуется постельный режим. Им дают грызть сухари. Это облегчит отток гноя из полости среднего уха. Без назначения оториноларинголога детям не закапывают в уши никаких лекарств. Ребенка срочно госпитализируют, если появляются следующие тревожные сигналы: 1) чрезмерная сонливость или усиление беспокойства (непрерывный плач); 2) учащение рвоты; 3) сильная боль, припухлость и краснота за ухом. Остановка дыханияПри остановке дыхания проводят искусственное дыхание «рот-в-рот», при необходимости сочетая его с закрытым массажем сердца. Ребенка укладывают на спину и очищают рот от рвотных масс. Затем, положив одну руку на лоб, другой сдвигают подбородок вперед, чтобы образовалось необходимое пространство для прохождения воздуха в верхние дыхательные пути. Для осуществления искусственного дыхания можно воспользоваться специальным устройством – дыхательной трубкой, маской, мешком и др. Если их под руками не окажется, то у детей до 1 года охватывают ртом нос и рот ребенка, у детей более старшего возраста – только рот. Таким образом вдувают воздух в рот ребенка с частотой около 20 раз в минуту. После нескольких вдохов следует проверить, поднимается ли при вдохе грудь ребенка. Если этого не происходит, необходимо повторно проверить дыхательные пути ребенка. Одновременно контролируют пульс. Если он прощупывается, искусственное дыхание продолжают до появления самостоятельных дыхательных движений, если нет, прибегают к одновременному закрытому массажу сердца. Весь комплекс реанимационных мероприятий удобнее проводить двум взрослым. У грудных детей закрытый массаж сердца проводят двумя пальцами (указательным и средним), надавливая ими на нижнюю часть грудины на глубину 1,5–2,5 см, детям более старшего возраста надавливают на грудину одной рукой. Для закрытого массажа сердца следует положить ребенка на твердую поверхность (обеденный или пеленальный стол, медицинскую кушетку и т. п.). Через каждые 5–6 надавливаний на грудную клетку проводят 3–4 приема искусственного дыхания. У детей до 8 лет соотношение искусственного дыхания и закрытого массажа сердца 1:5, если помощь оказывают два человека, и 2:15 – если один. КровотеченияПри возникновении носового кровотечения ребенка надо уложить, приподняв верхнюю половину туловища, наклонив голову ребенка вперед. При этом надо расстегнуть воротник, ослабить ремень или пояс. Ни в коем случае нельзя запрокидывать голову. Это не способствует остановке кровотечения и может вызвать у ребенка рвоту при заглатывании крови. Если кровотечение несильное, достаточно плотно прижать пальцами крылья носа к носовой перегородке на 2–3 мин. При сильном кровотечении рекомендуется ввести в передний отдел носа ватный тампон, смоченный перекисью водорода, и на переносицу положить холодный компресс. При продолжающемся кровотечении к затылку прикладывают пузырь со льдом. Если через 20–30 мин, несмотря на принятые меры, кровотечение продолжается, необходимо вызвать «скорую помощь». Небольшие кровоточащие ранки надо промыть кипяченой водой, смазать антисептическим средством (настойкой йода, бриллиантовой зеленью и др.). Царапины и порезы можно смазать специальным клеем БФ-6 или наложить кровоостанавливающий пластырь. На неглубокие кровоточащие повреждения накладывают стерильную давящую повязку. При артериальном кровотечении до приезда «скорой помощи» надо пережать крупную артерию выше места повреждения пальцем или наложить жгут. Для этого накладывают несколько плотных витков (до полной остановки кровотечения) и надежно завязывают или скрепляют концы жгута с помощью цепочки и крючка. Импровизированный жгут (пояс, ремень и т. п.) перетягивают с помощью закрутки (куска дерева, толстого карандаша и т. п.) до полной остановки кровотечения. В месте наложения жгута прикрепляют записку, где указывают точное время его наложения. Следует помнить, что жгут можно оставлять в теплое время года не более полутора часов и не дольше 20–30 мин зимой. Если за это время не удается доставить ребенка в лечебное учреждение или вызвать на место происшествия машину «скорой помощи», надо обязательно на 10–15 мин распустить жгут, прижав на это время поврежденный сосуд пальцами. Переломы и вывихиПри подозрении на перелом костей ребенку надо дать обезболивающее средство и остановить возникшее кровотечение, не усугубив при этом состояние пострадавшего. После остановки кровотечения и защиты раны от загрязнения накладывают шину. В качестве шин можно использовать самые различные средства: кусок доски, толстые ветки, картон, лыжи, зонт и т. п. Главное правило при наложении шины – обеспечить неподвижность по крайней мере двух суставов: одного выше, другого ниже перелома. Например, при переломе костей голени транспортную шину надо наложить таким образом, чтобы она захватывала коленный и голеностопный суставы, при переломе костей предплечья – лучезапястный и локтевой и т. п. При некоторых переломах обездвиживают не два, а три сустава. Например, при переломах плечевой кости шину накладывают таким образом, чтобы она захватывала плечевой, локтевой и лучезапястный суставы; при переломах бедренной кости шинируется тазобедренный, коленный и голеностопный суставы. Кроме того, надо приложить к месту травмы пузырь со льдом. Шины лучше всего накладывать на обнаженную часть тела, укутав ее предварительно ватой, особенно те места, которые подвергаются наибольшему давлению (костные выступы и т. п.). При отсутствии ваты для подкладки можно употребить любую материю, а в крайнем случае обойтись без всякой подкладки. Часто транспортные шины накладывают поверх одежды, под которой остаются закрытые стерильными перевязочными материалами раны. Можно также обертывать ватой не поврежденную конечность, а шину. Приготовленная соответствующим образом шина (изогнутая, если это представляется возможным, по положению поврежденной конечности и обернутая ватой или тканью) должна быть плотно укреплена на поврежденной части тела бинтами, косынками, платками, полосками белья и т. п. При шинировании конечности ей по возможности придают физиологическое положение (чаще всего со слегка согнутыми суставами) с целью ослабить натяжение мышц и сухожилий и обеспечить конечности максимальный покой или фиксируют ее в том положении, в каком она находится. Костные обломки, торчащие в ране при открытом переломе, не следует вправлять во избежание усиления боли, вторичного повреждения тканей и занесения инфекции в глубину тела. Транспортировка пострадавших с переломами костей должна производиться в сидячем (переломы верхних конечностей) или лежачем положении (переломы нижних конечностей, позвоночника, костей черепа и т. п.). При вывихах нельзя тянуть или дергать поврежденную конечность. Этим можно только усугубить тяжелое состояние ребенка. Первая помощь при вывихах, как и при переломах, направлена на уменьшение возникшей боли – холод и придание неподвижности конечности. Следует учесть, что свежие вывихи вправляются значительно легче, чем застарелые, поэтому важно как можно скорее доставить пострадавшего в близлежащее лечебное учреждение. |
|
||
|
Главная | В избранное | Наш E-MAIL | Прислать материал | Нашёл ошибку | Верх |
||||
|
|
||||
