|
||||
|
|
Полезно помнить, что слова выдуманы человеком. Слова, которыми пользуются в жизни...Полезно помнить, что слова выдуманы человеком. Слова, которыми пользуются в жизни, имеют часто расплывчатый характер. Не все понимают одинаково слова сила и красота, энергия и напряжение. Да и «хорошая» погода разная для разных людей. В науке такое положение дел не имеет места, во всяком случае не должно иметь. В особенности нетерпимо относятся к неточному использованию слов в физике. Простейшие физические понятия придумывались для описания свойств и поведения предметов и тел, среди которых идет наша жизнь, короче говоря, для «больших» тел или, как еще мы говорим, для тел макроскопических. Какие понятия, заимствованные из макромира, можно применять к молекулам? Все или некоторые? Истина лежит посредине. А как обстоит дело с геометрическими и механическими понятиями? Можно ли говорить о форме молекулы, о ее упругости, о модуле изгиба и кручения, наконец, о пластичности молекул? Имеют ли смысл, и какой, понятия внутримолекулярных и межмолекулярных сил? Цель этой статьи – показать, что с известными оговорками перенос на молекулу геометрических и механических понятий не только возможен, но и целесообразен. Эта фраза означает следующее. В ряде случаев о молекуле можно говорить как о большом теле. Тело, которому данную молекулу можно уподобить, назовем механической моделью молекулы. Наша задача – рассказать, как эта модель строится и как используется для решения различных физических проблем. Механическая модель молекулы получила в последнее время широкое распространение в связи с интересом к громадным (по сравнению с атомом) молекулам, из которых построены синтетические полимеры – капрон, найлон, полиэтилен (эти названия известны теперь каждому), а также важнейшие для жизнедеятельности животных и растений вещества – белки, нуклеиновые кислоты и так далее. Всякое «изображение» молекулы должно состоять из описания взаимного расположения атомных ядер и характеристики движущихся около этих ядер электронов. Химический опыт позволяет установить атомное строение молекулы (построить ее атомную модель), то есть указать, из каких атомов и как связанных друг с другом состоит молекула. Часть электронов тесно связана с определенными атомами, другая часть «обобществлена». Про эти электроны химики говорят – «они осуществляют химическую связь». Конечно, атомная модель молекулы значительно проще электронно-ядерной. Но эта простота достигается за счет существенной потери. Теряется знание закона взаимодействия «строительных» частиц. В электронно-ядерной модели взаимодействие между частицами, обеспечивающее структуру и свойства молекулы, – это электрическое взаимодействие между электронами и ядрами. Оно описывается законом Кулона: энергия взаимодействия электрона и ядра (или двух электронов, или двух ядер) равна e1e2/r (r – мгновенное расстояние между частичками.) Что же касается закона взаимодействия атомов, то он более сложен. Может быть, испугаться этой трудности и предпочесть ясную электронно-ядерную картину молекулы? Нет, это было бы неверно. Правдивость самой картины отнюдь не является ее главным достоинством. Важно, чтобы наша модель молекулы хорошо «работала». А «хорошо работать» – это значит быстро и надежно предсказывать. Как бы точна ни была модель, но если «работать» с ней трудно, то мы задумаемся о другой, пусть более грубой, но зато более «работоспособной» модели. Именно поэтому при изучении геометрии и механики молекулы мы отдаем предпочтение атомной модели. Сделать расчеты с помощью электронно-ядерной модели молекулы оказывается в этом случае нереалистичным, когда речь идет об интересующих нас проблемах: слишком много взаимодействующих частиц. В то же время атомная модель молекулы позволяет истолковать и предсказать большую совокупность явлений. В механической модели молекулы мы «забываем» про электроны и рассматриваем атом как кирпич мироздания. В механической модели за структуру и свойства молекулы отвечают взаимодействия атомов. Модель молекулы можно нарисовать на бумаге, изготовить из проволоки, из шариков на пружинках… Существует множество типов моделей. Подходящим масштабом является сто миллионов. Размеры молекул указывают обычно в ангстремах. Один ангстрем – это стомилионная доля сантиметра. Расстояния между центрами атомов лежат в границах 1–2 ангстрема. Поэтому и удобен стомилионный масштаб: расположив центры «атомов» на расстояниях один-два сантиметра, мы легко разглядим детали строения, да и изготовлять шарики и срезы шариков (зачем нужны срезы, мы скажем ниже) такого размера вполне удобно. В зависимости от целей и от личных вкусов используют те или иные модели. Пока что остановимся на скелетных моделях, то есть таких, в которых показаны (стерженьками) силы, соединяющие атомы в молекулу. Эти силы называют химическими, или валентными. О том, какие атомы с какими связаны, химики научились судить по химическим реакциям еще задолго до того, как физики научились устанавливать структуру молекулы своими методами. Итак, обратившись за указанием к химику, мы получаем от него сведения о том, как атомы присоединены друг к другу. Скажем, формула молекулы этилового спирта C2H5OH еще ничего не говорит о том, как соединены атомы между собой. Эта формула – так называемая брутто формула сообщает лишь сведения о составе. Разъясняя строение молекулы химик укажет нам: три атома водорода (рис. 1) соедините черточками с атомом углерода. (Эта группа атомов называется метильной.) Теперь, пожалуйста, соедините валентной черточкой атом углерода этой группы со вторым атомом углерода. Этот второй атом, кроме того, надо связать с парой атомов водорода, а четвертую черточку (раз четыре черточки от одного атома, значит, он четырехвалентный) приведите к атому кислорода. Оставшийся атом водорода следует присоединить к атому кислорода. 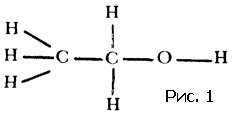 Физик сразу же задаст вопрос. А на каком расстоянии атомы, под какими углами друг к другу идут валентные черточки? На подобные вопросы ответы могут быть получены физическими исследованиями. Оставим пока что в стороне вопрос о том, каким образом устанавливается физическими опытами геометрия молекулы. Обширные данные собраны в толстые справочники. В них можно найти сведения о том, на каких расстояниях находятся химически связанные атомы и какие углы (их называют валентными углами) образуют между собой «стерженьки», символизирующие химические валентные силы. Если не очень придираться к тонким различиям, то окажется, что расстояния между атомами одного сорта достаточно универсальны, правда, валентные углы более переменчивы. Поэтому предсказать структуру молекулы не всегда просто. Но об этом речь будет впереди. Теперь мы можем обратиться к проблеме межмолекулярных сил. То, что между молекулами действуют силы, очевидно из самых элементарных соображений. Пар любого вещества при подходящих условиях сгущается в каплю. Если так, то молекулы несомненно притягиваются. Вещество сопротивляется сжатию. Значит, находясь на малых расстояниях, молекулы отталкиваются друг от друга. Если на больших расстояниях существует притяжение, а на малых отталкивание, значит, есть и равновесное состояние, когда эти силы уравновешиваются. Вместо сил взаимодействия гораздо удобнее говорить об энергии взаимодействия.[1] Энергию взаимодействия и мерить легче, и понятие это более простое и ясное, чем сила.[2] Энергией взаимодействия молекул (или атомов, или любых других частиц или тел) называется работа, которую нужно затратить для того, чтобы развести частицы далеко друг от друга – так, чтобы взаимодействие прекратилось. Математик скажет – отдалить на бесконечно большое расстояние. Чем ближе частицы, тем больше работа, необходимая для того, чтобы их оторвать друг от друга. Максимального значения эта работа достигает тогда, когда частицы находятся на равновесном расстоянии друг от друга. Эту работу называют энергией связи. Если частицы сжаты и отталкиваются, то есть находятся на расстоянии меньше равновесного, то работа разрыва станет, конечно, меньше. Типичная кривая энергии взаимодействия показана на рисунке 2. Все кривые имеют такой характер. Но для конкретных целей надо знать параметры кривой. Прежде всего важна глубина ямы и ее абсцисса – равновесное расстояние. Но в ряде случаев нужны и более подробные сведения о крутизне кривой слева и справа от положения равновесия. Все сведения о веществе таятся в кривой взаимодействия частиц. Зная вид этой кривой, можно рассчитать тепловые и механические свойства вещества. 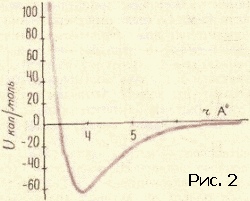 Кривая энергия взаимодействия, с которой мы вас познакомили, есть зависимость энергии от расстояния. Но о каком расстоянии идет речь? Если наc интересует газообразное состояние вещества, то картина ясна. Молекулы находятся на расстояниях много больше их собственных размеров. Поэтому можно считать, что энергия зависит только от расстояния между центрами молекул. Но в жидкостях и твердых телах дело обстоит совсем не так просто. Здесь расстояние между центрами молекул примерно равно размеру молекулы. В этом случае энергия взаимодействия будет зависеть от взаимной ориентации молекул. Наша кривая энергии теряет физический смысл, если под расстоянием понимать расстояние между центрами молекул. До самого последнего времени положение дела казалось безвыходным. Больше четверти века тому назад, рассматривая взаимное расположение молекул в кристаллах, автор обратил внимание на то, что центр каждого атома стремится расположиться между центрами атомов соседней молекулы. Оказалось также, что взаимное расположение атомов молекулы по отншению к атомам соседней молекулы не зависит от того, в какую молекулу эти атомы входят. Короче говоря, создавалось впечатление, что атомы молекулы ведут себя индивидуально, так сказать, не обращая внимания на своих соседей в своей же молекуле. Эти наблюдения позволили высказать гипотезу: энергия взаимодействия молекул равняется энергии взаимодействия всех пар атомов этих молекул. Или, как принято говорить в физике, энергия взаимодействия молекулы аддитивно складывается из энергии взаимодействия атомов, составляющих молекулу. Проверить это предположение оказалось возможным лишь тогда, когда в обиход вошли электронно-счетные машины. Возьмем относительно небольшую молекулу, состоящую, скажем, из двадцати атомов. В соседней молекуле тоже двадцать атомов. Значит, взаимодействие только этих двух молекул есть сумма из 20?20=400 слагаемых. Но ближайших соседей несколько. Если молекула более или менее шаровидна, то ближайших соседей будет 12 (столько, сколько соседей у каждого шара в плотной упаковке шаров (рис. 3): в одном слое у шара шесть соседей, да по три шара можно положить на этот слой сверху и снизу), а значит, число взаимодействий молекулы только с ближайшими соседями будет измеряться многими тысячами. Каждое слагаемое надо оценивать по кривой энергии, которая теперь приобретает смысл кривой взаимодействия атомов, а не молекул. 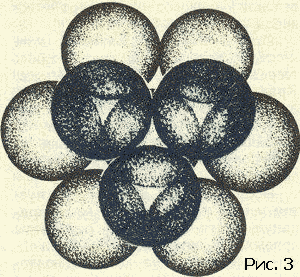 Для каждой пары атомов надо знать кривую энергии взаимодействия. Для огромного класса углеводородов – веществ, состоящих из атомов двух сортов – углерода и водорода, – надо знать три кривые взаимодействия: углерод – углерод, водород – водород и углерод – водород. Откуда взять сведения об этих кривых? К сожалению, нет никаких теоретических способов их вывода. Кривые энергии приходится определять из опыта. Так как подбор нужных кривых – операция весьма типичная для многих областей физики, то мы опишем эту интересную работу подробней. Исследователь, начиная на пустом месте, должен прежде всего прикинуть хотя бы грубо параметры кривых. Из опыта известны ближайшие расстояния, на которые подходят друг к другу атомы соседних молекул. Внимательно просматривая эти данные, мы выясним, что два атома водорода не бывают ближе друг к другу, чем на расстоянии 2–3 ангстрема, два атома углерода разных молекул не приблизятся друг к другу ближе, чем на 3–4 ангстрема и т.д. Эти данные взяты из исследований твердых тел. Молекулы в твердом теле несколько сжаты силами взаимодействия. Поэтому мы думаем, что равновесные расстояния на соответствующих кривых атом-атомного взаимодействия должны быть несколько больше приведенных выше цифр. По ряду косвенных соображений ясно, что это превышение должно быть процентов на десять. Поэтому для начала можно выбрать абсциссы минимумов на кривых, которые мы обсуждаем в качестве примера, в точках 2,6 и 3,8 ангстрема. Сведения об энергии связи, то есть о глубине ямы кривой энергии, надо «вытянуть» из данных по теплотам испарения. Напомним, что при малых давлениях твердое вещество испаряется. Теплота этого фазового превращения может быть достаточно точно измерена. Затраченная на испарение кристалла теплота пошла на то, чтобы развести его молекулы на далекое расстояние. С некоторыми поправками, на которых мы не станем задерживаться, измерение теплоты испарения приводит нас к величине энергии взаимодействия всех молекул. Конечно, положение дел не очень простое – измеряется суммарная величина, а судить надо о слагаемых. Углеводородные вещества, состоящие из молекул, содержащих 10–20 атомов, имеют теплоты испарения порядка 10–20 ккал/моль. Если полагать, что в основном играет роль взаимодействие соседних молекул, то эта цифра складывается из тысячи атом-атомных взаимодействий. Значит, глубины ям на кривых энергии должны быть порядка 0,01 ккал/моль. Таким образом приходят к примерным оценкам параметров энергетических кривых атом-атомного взаимодействия и с их помощью конструируют кривые первого приближения; далее рассчитывают (вот здесь-то и нужны ЭВМ) свойства большого числа веществ и сравнивают результаты расчета с опытом. Становится очевидной необходимость тех или иных поправок. Действуя последовательно, пробуя и ошибаясь (физики так и говорят – работать методом проб и ошибок), в конце концов приходим к оптимальным кривым атом-атомного взаимодействия для многих пар атомов. В общем расчет громоздкий и исследование гипотезы аддитивности было проведено лишь недавно. Результат оказался весьма утешительным. Оказалось, что предположение выполняется с хорошей точностью. Заранее не очевиден успех этой работы. Если бы гипотеза была несправедлива, не работал бы принцип аддитивности, не вели бы себя одинаково атомы одного химического сорта, входящие в разные молекулы, то ЭВМ сообщила бы нам, что не может подобрать кривые так, чтобы они давали цифры, хотя бы сносно совпадающие с опытом. Напротив, успех работы по подбору кривых показывает, что гипотезы, положенные в основу расчета, справедливы. Доказав справедливость аддитивного представления энергии взаимодействия молекул, мы подводим базу под понятие формы молекулы. Построив по опытным данным «скелет» молекулы, мы можем «одеть его плотью» с помощью так называемых межмолекулярных радиусов. Если на кривой атом-атомного взаимодействия водорода минимум лежит при 2,6 ангстрема, то межмолекулярный радиус водорода надо взять равным 1,3 ангстрема. Выяснив значения радиусов, мы можем приступить к окантовке молекулы так, как это показано на рисунке 4. Межмолекулярные радиусы больше межатомных расстояний. Поэтому сферы, проведенные межмолекулярными радиусами, будут пересекаться. Части сферических поверхностей, проходящие внутри соседних сфер, нас не интересуют. Внешние же части образуют поверхность молекулы (рис. 5). Если надо собрать объемную модель молекулы, то целесообразно сделать это при помощи участков срезанных сфер. Каждая сфера срезается в соответствии с валентностью. Из таких срезанных сфер можно быстро собрать модель любой молекулы. 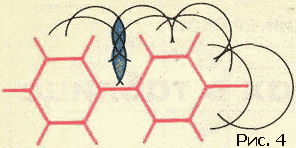 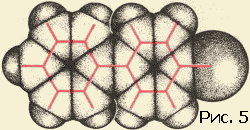 Конструирование модели молекулы и исследование межмолекулярных сил сильно упрощается в том случае, если молекулу можно считать жесткой. Однако такое приближение годится далеко не всегда. Целый ряд замечательных свойств вещества определяется гибкостью молекулы. Чтобы понять, в каком смысле молекула гибка, надо продолжить рассуждения об атом-атомных взаимодействиях, распространив их на внутримолекулярные взаимодействия. Это очень важная проблема. Но ей нужно посвятить отдельную статью. Примечания:1 См. статью Г.Я. Мякишева «Взаимодействие атомов и молекул», «Квант» № 11, 1971 г. 2 По кривой энергии взаимодействия можно найти и силу: сила численно равна тангенсу угла наклона касательной к кривой энергии взаимодействия. "> |
|
||
|
Главная | В избранное | Наш E-MAIL | Прислать материал | Нашёл ошибку | Верх |
||||
|
|
||||
