|
||||
|
|
ФИЗИКО-ХИМИЧЕСКАЯ ПРИРОДА ЖИЗНИ Только физиология и биофизика не могут дать объяснение жизни. В ее основе есть нечто более высокое. Но реализация жизни происходит через конкретные физические и химические процессы. Они могут быть разными. Жизнь, как храм, состоит из разных кирпичей и строительных блоков. Специалисты рассматривают разные варианты материальной реализации жизни. Один из них земной. Но он не может считаться единственным. В основу земной жизни положена вода как растворитель. Но эту роль может выполнять аммиак, кремний и другие вещества. Чтобы что-нибудь понять в этом плане, нам придется окунуться в химию. Конечно, не во всю химию, а только в некоторые ее понятия и положения. Поскольку наши книги рассчитаны на неспециалистов, то мы приведем некоторые сведения, которые взяты из программ средней школы. Но без этих сведений трудно будет понять основной текст. Начнем с атома. Слово «атом» означает «неделимый». Так оно и есть. Но не совсем. Если уж атом начнет делиться, то прежнее вещество исчезает и появляется новое. Поэтому атом в химическом плане является неделимым. Примитивная конструкция атома напоминает нашу Солнечную систему. В центре находится массивное ядро, вокруг которого на разных орбитах вращаются очень легкие электроны. На самом деле все значительно сложнее. Например, электрон нельзя считать только частицей (шариком). Во многих физических экспериментах он ведет себя как волна. Но для понимания (достаточно наглядного) химических процессов такая модель строения атома вполне пригодна. Нормальный, полноценный атом является электрически нейтральным, то есть у него нет электрического заряда. А точнее, положительный электрический заряд ядра атома полностью компенсируется отрицательным суммарным электрическим зарядом всех орбитальных электронов. Поэтому в сумме получается нуль. Если же атом не нормальный, то возможны два варианта. В одном из них к атому присоединился один или несколько лишних (избыточных) орбитальных электронов. Тогда суммарный электрический заряд всего атома в целом является отрицательным, поскольку эти избыточные электроны (как и вообще все электроны) заряжены отрицательно. Во втором варианте нормальный атом потерял один или несколько электронов. Тогда будет преобладать положительный электрический заряд ядра. Важно, что заряд электрона строго фиксирован по величине. Он не может быть ни больше, ни меньше этой величины. В природе не встречается ни половины, ни четверти заряда электрона. Вообще любая величина электрического заряда обязана быть кратной величине электрического заряда электрона. Деформированный атом называют ионом. Как мы уже видели, он может быть положительным и отрицательным. Такое состояние атома является ненормальным и недолговечным, потому что в нем положительный заряд не скомпенсирован отрицательным. Кроме того, число орбитальных электронов или больше или меньше нормы. Проходит какое-то время, и ненормальный атом (ион) приходит в нормальное состояние. Для этого он расстается с излишним электроном (или электронами) или же возвращает себе утерянные электроны. Одной из главных характеристик любого химического элемента является его атомный номер в периодической системе Менделеева. Атомный номер равен положительному электрическому заряду ядра, который выражен в элементарных единицах электричества, то есть в зарядах одного электрона. Для нормального атома атомный номер равен числу орбитальных электронов, вращающихся вокруг ядра. Атомный номер очень важен. Именно он определяет химические свойства атома и вообще данного химического элемента. Самая простая конструкция у атома водорода. Он состоит из одного протона (это ядро) и одного отрицательного электрона, который вращается вокруг этого ядра. Протон тяжелее электрона в 1840 раз. Поэтому в ядре атома и сосредоточена практически вся масса. На долю орбитальных электронов приходится только пренебрежимо малая доля массы атома. Как электрический заряд атома измеряют в зарядах электрона, так массу атома измеряют в массах протона. Ядро атома водорода состоит из одного протона. Но в ядрах более сложных химических элементов кроме протонов имеются и нейтроны. Это электрически нейтральные протоны. У этих частиц масса равна в точности массе протонов, но у них нет никакого электрического заряда. Кроме обычного водорода, ядро атома которого состоит из одной частицы (протона), имеется и двойной водород (дейтерий), у которого ядро атома состоит из двух частиц — одного протона и одного нейтрона. Имеется и водород — тритий, у которого в ядре содержатся три частицы — один протон и два нейтрона. Свойства у этих трех разновидностей водорода разные, поскольку их атомные веса разные. У нормального водорода атомный вес равен 1. У дейтерия он равен 2, а у трития — 3. Но это физические свойства. А химические свойства у всех этих разновидностей водорода одинаковые, поскольку у них одинаковый номер в периодической системе Менделеева, то есть у них одинаковое число орбитальных электронов. Такие химические элементы, а точнее — разновидности одного и того же химического элемента называются изотопами («изо» — значит «равный»). Речь идет о равных, одинаковых номерах или, другими словами, о равном числе орбитальных электронов. Орбитальные уровни вращаются вокруг ядра не так, как им заблагорассудится. Здесь, как и везде в природе, имеются строгие законы, которые нельзя нарушить. Имеются определенные электронные уровни (их еще называют оболочками), на которых может находиться только строго определенное количество электронов. На самой нижней оболочке могут находиться только два электрона. Так, у химического элемента гелия эта оболочка заполнена. У атома гелия два орбитальных электрона. Атомный номер гелия равен двум. Когда заполнена первая оболочка, начинается заселение электронами второй оболочки. Эта оболочка дальше удалена от ядра. Она имеет целых восемь вакансий для электронов. За этими двумя оболочками следуют другие, на которых могут разместиться восемь, восемнадцать, еще раз восемнадцать и тридцать два электрона. Когда два атома приближаются друг к другу, то на определенном расстоянии они испытывают действие сил сопротивления. Это наступает, когда соприкасаются самые внешние оболочки атомов. Собственно именно эти внешние оболочки с их электронами и определяют химические свойства данного элемента. Так, если внешняя оболочка упакована полностью (заполнена), то атом инертен. Он очень неохотно вступает в различные взаимодействия с другими атомами или молекулами. В обычных условиях такие атомы вообще не образуют соединений. Совсем другое дело, если на внешней оболочке имеются вакансии, то есть свободные места. В этом случае вакансии постараются занять электроны другого, соседнего атома. Здесь работает закон очереди. В новую очередь переходят те, кто находится в хвосте. Поэтому кандидатами на вакантные места являются только электроны, которые находятся на самой внешней оболочке другого атома. Но они при этом поступают очень осмотрительно: занимают вакантные места в не своем атоме, но места в своем атоме не сдают. Так они являются слугами двух господ, а точнее — атомов. Они и связывают эти атомы в единое целое. Это целое, образованное описанным выше способом, называется молекулой. Способность атома соединяться с водородными атомами или их эквивалентами, называется валентностью. Самая большая нормальная валентность атома определяется числом свободных мест на внешней оболочке, которые он может предоставить другим атомам. Но имеется и другая возможность того, как осуществить связь между атомами. Данный атом может не только предоставить вакансии для электронов других атомов, но он может отдать свои свободные электроны ради такой связи. Это тоже валентность, то есть связь. Она определяется числом тех электронов, которые атом может отдать для заполнения свободных мест во внешних оболочках других атомов. На практике самая большая (максимальная) валентность может и не быть достигнута. Валентность никогда не превышает восьми. Важно подробнее рассмотреть связи углерода. Он имеет четыре электрона на внешней оболочке. Заполненной эта оболочка становится только при восьми. Это значит, что число электронов, которое может принять или отдать атом углерода, в обоих случаях равно четырем. Это свойство атомов водорода принципиально важно. Благодаря ему атомы углерода легко соединяются друг с другом в цепочки. Благодаря этому именно углерод занимает исключительное место в химии земной жизни. У других элементов все по-другому. Так, азот имеет на внешней оболочке три свободных места и пять электронов. Это значит, что его валентность равна соответственно трем или пяти. Связь между атомами может осуществляться одним или несколькими электронами. В первом случае связь является одиночной. Если связь осуществляют два электрона, то связь называют двойной, и т. д. Прочность созданной таким путем связи зависит от того, как много надо затратить энергии для того, чтобы эту связь разорвать. На научном языке это значит, что прочность связи зависит от относительных электрических потенциалов соединяющихся атомов. Потенциал — это возможность, способность. Мы описали наиболее распространенные связи между атомами. Но имеются и более слабые связи. Например, когда единственный орбитальный электрон атома водорода присоединяется к другому атому, то с противоположной стороны вблизи ядра возникает небольшой местный избыток положительного заряда. А это открывает возможность установления нового типа связи между атомами. Она более слабая, чем связь путем обмена электронами. Когда атомы благодаря описанным возможностям объединяются, то они образуют соединения. В соединения мо-гут входить атомы одного химического элемента, или же они состоят из атомов различных элементов. Легче всего одному атому зацепиться за другой в том случае, если они дальше находятся друг около друга. Кроме того, соединение создается легче, если атомы находятся ближе друг к другу. Сточки зрения физики это означает, что чем выше температура, тем этот процесс идет медленнее. Это и понятно — чем выше температура, тем с большими скоростями носятся атомы и молекулы. Температура и определяется через скорость движения атомов и молекул. Кроме того, чем больше давление, то есть чем плотнее прижаты друг к другу атомы, тем процесс идет быстрее. Таким образом, с понижением температуры и с увеличением давления количество возможных соединений увеличивается. При этом речь не идет о столь высоких давлениях, при которых уже начинают разрушаться сами атомы и молекулы. Если же температура очень высокая, как в атмосферах горячих звезд и горячих диффузных туманностях, никакие химические соединения образоваться не могут. Каждый отдельный атом носится сам по себе, и ему не дают возможности соединиться с соседним атомом. Поэтому в атмосферах горячих звезд могут существовать только одноатомные газы. Но если температура понижается и атомы двигаются с меньшей скоростью, у них появляется возможность и время организовать с соседями некие конструкции, соединения. Самой простой такой конструкцией является молекула. В ней связь между отдельными атомами очень сильная. Если температура достаточно высокая, то есть скорости движения атомов большие, то слабая конструкция тут же развалится и атомы разбегутся в разные стороны. Молекула же является конструкцией с сильными связями, и она до определенной температуры остается целой. Чем ниже температура, тем больше возможностей у атомов образовывать различные соединения. Кроме молекул обычных образуются более сложные соединения с большим молекулярным весом и более слабыми связями. В качестве примера можно взять кислород. Его атомы могут соединяться друг с другом и при этом образовывать конструкции, состоящие из двух атомов (О2), трех атомов (О3) — это озон, четырех атомов (О4). Они могут образовывать конструкции и с другими химическими элементами. Когда атом кислорода соединяется с атомом углерода, образуется окись углерода СО. Это ненасыщенное соединение с двумя свободными валентностями. Другими словами, здесь открыт путь еще для двух участников, которые могут войти в эту корпорацию. Если все вакансии (валентности) заняты, то соединение считают насыщенным, спроса на участников больше нет. Примером такой конструкции является соединение СО2, в котором все валентности заняты. Нельзя говорить о проблемах жизни и вообще Земли, не упомянув о СО2. Каждый газ обладает своими особыми возможностями и свойствами. Так, атомы каждого газа объединяются в сложные конструкции при определенной температуре. Эту температуру называют критической. Если температура становится ниже критической для данного газа, то его атомы и молекулы начинают объединяться в более крупные конструкции. Если температура выше критической, то газ является паром. Если температура ниже критической, а давление достаточно высокое, то часть газа-пара переходит в жидкое состояние, начинает конденсироваться. При температуре выше критической это не может произойти, несмотря на очень высокое давление. Дело в том, что газ превращается в жидкость тогда, когда внешнее давление больше собственного давления газа-пара. А это давление зависит от температуры. Если же повышать температуру при постоянном давлении, которое равно нормальному атмосферному давлению (760 мм рт. ст.), то при определенной температуре вся жидкость превратится в пар. Эта температура и называется точкой кипения данного вещества при атмосферном давлении. Можно говорить, что эта температура является точкой сжижения. Совершенно ясно, что для каждого химического элемента эта точка кипения (сжижения) разная по величине температуры. Поведение жидкости отличается от поведения газов. Молекулы в жидкости также образуют конструкции. Но они очень напоминают кристаллы, в которых не все направления равноправны, равнозначны. Там имеется очень много направлений пониженной прочности. Поэтому кристалл рвется, деформируется, и жидкость течет. Если бы эта прочность была больше, то кристалл оставался бы кристаллом. Эта прочность достигается при дальнейшем понижении температуры. Так можно достичь определенной температуры (для каждой жидкости разной), при которой жидкость превращается в настоящие, крепкие кристаллы. Жидкость переходит в твердую фазу, она замерзает. Эта температура называется точкой замерзания. Точка замерзания (плавления) для каждого вещества своя. Эта температура зависит от давления, хотя и очень слабо. В газообразном состоянии атомы движутся с большой скоростью, то есть они обладают большой кинетической энергией. Когда газ превращается в жидкость, то скорости движения атомов и молекул значительно уменьшаются, то есть, уменьшается их кинетическая энергия. Она еще больше уменьшается, когда жидкость переходит в твердую фазу. Но энергия исчезать и возникать не может. Она всегда сохраняется постоянной в сумме и может только переходить из одного вида в другой. В случае превращения газа в жидкость лишняя энергия выделяется в виде тепла. То же самое происходит при превращении жидкости в твердое тело. Но если вы хотите осуществить обратное превращение — твердое тело (лед) превратить в жидкость (воду), а воду в пар, вы должны эту выделенную теплоту вернуть веществу обратно. Как видите, в природе законы выполняются в полной мере, и никто не может их обойти. Очень важно то, что когда вы возвращаете льду тепло, чтобы он снова мог превратиться в воду, которой он уже был, то температура льда не повышается. Лед использует возвращаемую ему энергию (теплоту) строго по назначению — на переход в жидкое состояние. И только после того, как весь лед превратиться в воду, поступающую к нему (к ней) энергию в виде тепла он использует на повышение температуры. Любое структурное изменение вещества, физическое или химическое, всегда связано с энергией. Оно при этом или выделяется, или поглощается. Это тепловая энергия. Наиболее частые физические структурные превращения — это затвердевание и плавление, а также испарение и сжижение (конденсация). В природе все строго определено. Так, та теплота, которая поглощается веществом и идет на превращение одной фазы данного вещества в другую, остается в пересчете на один грамм данного вещества строго постоянной. Эту теплоту называют скрытой, поскольку ее введение в вещество не вызывает увеличения температуры. Она как будто не проявляет своего присутствия через видимое увеличение температуры. В качестве примера можно указать, что на превращение одного грамма воды в пар при температуре 100 °C требуется 539 калорий. Справедливо обратное — при превращении одного грамма пара в воду (путем конденсации) выделяется в точности такое же количество тепловой энергии. Для Земли и человека вода — самое главное. Благодаря указанному свойству воды и сохраняется неизменным или маломеняющимся тепловое состояние планеты. Значит, вода стабилизирует климат Земли. Это мы подробно рассмотрели в книге «Озонные дыры и гибель человечества?». Любопытно, что переход вещества из одного фазового состояния в другое может быть задержан. Так, можно задержать кристаллизацию в переохлажденной жидкости. Известно, что переохлажденная жидкость с понижением температуры становится все плотнее и плотнее. Но при этом она все же не превращается в твердое тело в собственном смысле этого слова. Как ни странно это звучит, такой переохлажденной жидкостью является стекло. Стекло течет, это доказывает то, что старинные оконные стекла внизу толще, чем в верхней части. Собственно, переохлажденная жидкость отличается от твердого тела тем, что она не имеет четко выраженной точки (температуры) плавления. Когда переохлажденная жидкость поглощает тепло, она не переходит в жидкое нормальное состояние резко, а постепенно размягчается. Что же касается истинных твердых тел, то они бывают макро- и микрокристаллическими. В микрокристаллических твердых телах кристаллы слишком малы, для того чтобы их можно было увидеть невооруженным глазом. Когда образуются кристаллы, то молекулярные структуры в них исчезают. При этом атомы образуют сравнительно крупную решетку. Это можно видеть на рисунке 1, где изображено вольфрамовое острие диаметром около 150 ангстрем. Один ангстрем равен одной стотысячной доле миллиметра. Кристаллическая решетка может меняться в зависимости от давления и температуры. Примером разных кристаллических решеток могут служить алмаз и графит, которые являются модификациями углерода. Обычная соль NaCl состоит из кристаллов, в которых атомы образуют правильную решетку. Сейчас такие решетки изучают с помощью электронного микросита. Силикаты образуют самые различные кристаллы весьма сложной структуры. В определенных условиях кристаллы любого вещества 
имеют строго определенную форму. Это напоминает живой организм. В сущности, они тоже растут, пристраивая к своей поверхности новые решетки из молекул, которые они извлекают из окружающей среды. Этот процесс очень непростой. Он создает сам себя (растет) из материала, который содержится в окружающей среде. Поэтому и возникает аналогия между кристаллом и живым веществом. Когда органическая молекула действует как шаблон при самокопировании или самовоспроизведении, то происходит точно такой же процесс. Ведь кристаллизация родственна химическому процессу полимеризации, при котором одинаковые молекулы соединяются в цепочки большого молекулярного веса. Вполне можно рассматривать кристалл как одну молекулу полимера. Простой вариант полимеризации реализуется, когда сложные молекулы образуются из атомов одного сорта. Мы говорили о кислороде в виде О, О2, О3 и О4. Формально это можно считать начальной стадией кристаллизации. Она не имеет своего продолжения только потому, что температура для этого очень высокая, а давление слишком мало. Уникальным является углерод. Его атомы способны объединяться друг с другом и образовывать цепочки. Можно сказать, что органическая химия является химией углерода. Если к углероду добавить его соединения с водородом, то получается практически вся органическая химия. Да, собственно, деление химии на органическую и неорганическую весьма условно и не всегда целесообразно. Правда, с точки зрения решения проблемы жизни на Земле такое деление себя оправдывает. К проблеме жизни причастна органическая химия. Суть органической химии начинают изучать с парафинового ряда углеводородов. Это СН4, С2Н6, С4Н10… СnH2n+2. Записанные формулы изображают в следующем виде: Бутан и изобутан имеют одинаковую формулу С4Н10. Они отличаются только пространственным расположением атомов в молекуле и своими свойствами. Свойства их настолько разнятся, что их можно считать разными веществами. Их называют изомерами. Что касается парафинов, то это простейшие углеводороды. Это соединения с цепным строением. В них повторяется группа атомов с двумя свободными валентностями, которые способны образовывать связи. Пропан С3Н8 может быть записан как сумма Н + СН2 + СН2 + СН2 + Н. Этан С2Н6 образуется при полимеризации двух метиловых групп СН3. Каждая из этих групп имеет одну свободную валентность. Другие углеводороды и органические соединения можно получить из парафинов. Для этого надо Н и СН заменить другими атомами или их группами (их радикалами). Кроме того, надо осуществить структурную перестройку. Углерод кроме цепочки может образовывать кольца. Это мы наблюдали в циклических углеводородах. Одним из циклических углеводородов является бензол: (формула) бензол Здесь две черточки означают двойную связь. В органических соединениях бензольные кольца появляются в разных комбинациях и с разными замещениями. Собственно, сами углеводороды обычно не присутствуют в живых тканях. Они появляются главным образом в продуктах распада живых тканей. Да и для синтеза углеводородов биологические процессы не нужны, а точнее, не являются обязательными. Так, углеводороды образуются, например, при вулканической деятельности. Но, тем не менее, углеводороды являются тем стержнем, вокруг которого построено вещество жизни. Можно сказать, что жизнь начинается с углеводов, в которых углерод входит в соединение с составными частями молекулы воды, то есть с двумя атомами водорода и одним атомом кислорода. Химия — наука о растворах, и прежде всего о водных растворах. В идеальном растворе вещество распределено в виде отдельных молекул. Исключение составляют коллоидные растворы. В них растворенное вещество взвешено в виде частичек вещества. Эти частички настолько малы, что способны реагировать на удары отдельных молекул. Именно удары отдельных молекул и поддерживают частички вещества во взвешенном состоянии. Эти взвешенные частицы можно отфильтровать фильтром из пергамента или с помощью другой диа-литической мембраны. Кроме коллоидных растворов имеются и суспензии. Но в суспензиях частички вещества побольше, поэтому они оседают под действием силы тяжести. Удары молекул не в состоянии предотвратить этот процесс. Вода как растворитель образует ионные растворы. В них молекулы растворенного вещества расщеплены на электрически заряженные группы атомов или на ионы. Ион — это атом, у которого есть электрический заряд. Если у атома не хватает одного или больше орбитальных электронов, то он заряжен положительно, то есть является положительным ионом. Если же у атома имеется лишний орбитальный электрон, то он заряжен отрицательно, то есть является отрицательным ионом. Положительно заряженный атом еще называют катионом, а отрицательно заряженный — анионом. Отсюда происходят «катод» и «анод». Как это ни парадоксально звучит, но вода растворяется сама в себе, поскольку часть молекул воды диссоциирует (расщепляется) на две части — положительно заряженный ион Н+ и отрицательно заряженный ион НО—. Н+ — это протон, то есть ядро обычного водорода. Это ядро потеряло свой орбитальный электрон, поскольку он «прилип» к молекуле ОН, которая стала отрицательно заряженной. ОН— еще называют гидроксилом. После того как молекулы воды разорвались на ионы, она стала более активной. Ведь электрически заряженные частицы более активны, чем нейтральные. Если вещество, растворяясь в воде, образует положительный ион Н+, то есть протон, то это вещество называют кислотой. То вещество, которое при растворении в воде образует отрицательно заряженный гидроксил ОН—, называют основанием. Поскольку вода дает и то, и другое, то она одновременно является и кислотой и основанием. Правда, вода — это кислота очень сильная и одновременно очень слабое основание. А в целом плюс компенсирует минус, поэтому вода в целом остается нейтральной. Но, тем не менее, она проявляет свои свойства кислоты и свойства основания в том, что способна расщеплять молекулы некоторых соединений путем гидролиза. При этом вода действует в валентном отношении двойственно: по отношению к одной группе атомов в соединении вода действует как кислота, а по отношению к другой группе атомов в соединении — как основание. Что значит сильная или слабая кислота? Сила кислоты или основания определяется количеством положительных и отрицательных ионов. Именно ионы делают кислоты едкими. В водном растворе молекулы серной кислоты Н2SО4 диссоциируют (расщепляются) на положительные ионы Н+ (протоны) и отрицательно заряженные ионы SО42–. Этот ион имеет двойной отрицательный заряд. Основание NaOH в водном растворе образует положительный ион Na+ и отрицательный ион ОН—. Вполне логично, что кислота и основание при смешении энергично взаимодействуют. При этом положительные и отрицательные ионы нейтрализуют свои электрические заряды. Если взаимодействуют соляная кислота и основание NaOH, то образуются сульфат натрия и вода. Сульфат натрия — это соль. Когда же соль растворяется в воде, то молекулы соли диссоциируют с образованием ионов на составляющие ее части. Эти части не являются характерными ионами растворителя. Они образуют проводящий электричество раствор, который называют электролитом. Среди органических соединений также имеются кислоты и основания, которые могут реагировать друг с другом или с иными кислотами и основаниями. При этом образуются соли. Важную роль для жизни играет спирт. Это своего рода органическое основание. Если спирт взаимодействует с органической кислотой, то образуется мыльное вещество, которое называют сложным эфиром. Так же и альдегиды характеризуются концевой группой СОН, а органические кислоты — СООН. Если же в углеводороде половина атомов замещена гидроксильными группами ОН с потерей молекулы воды, то образуется углерод. Что касается углеводов, то они представляют собой соединения углерода и воды. Сюда входят и сахара и крахмалы. Углеводы — это основа жизни. Из них образуются многие другие органические соединения. Но живые организмы используют в качестве основного сырья не углеводороды, а углекислый газ и воду. Теперь рассмотрим непосредственно химические процессы и соединения, которые лежат в основе жизни. Жизнь — это расход энергии. А раз есть расход, то должно быть и поступление энергии. Как оно осуществляется? Некоторые сообщества живых организмов могут синтезировать органические вещества непосредственно из неорганических, которые они извлекают из окружающей среды. Такие организмы называются автотрофами, то есть они сами (авто) усваивают энергию окружающей среды. Гетеротрофы — это такие организмы, которые не могут добывать себе энергию сами из окружающей среды. Хотя они и поглощают из окружающей среды кислород, соли, воду и др., но этим они не решают энергетической проблемы своего существования. Поэтому они вынуждены пользоваться для построения своих тканей органическими веществами, которые приготовили ав-тотрофы. Эти вещества при усвоении частично разрушаются и химически перестраиваются. Это необходимо для того, чтобы удовлетворить потребности гетеротрофного организма. Непригодные продукты выбрасываются. Весь это процесс в целом называется обменом веществ, или метаболизмом. Автотрофы можно назвать первичными организмами. В энергетической цепи они стоят на первом месте. Гетеротрофы — вторичные организмы. Они используют автотрофы — растения и некоторые бактерии. Они получают энергию путем фотосинтеза. Если бы фотосинтез зеленых растений внезапно прекратился, то смогли бы выжить только некоторые простейшие и бактерии. Источником энергии является солнечное излучение. Оно поглощается зеленым пигментом, называемым хлорофиллом. Это процесс фотосинтеза. Энергия активирует различные реакции, включая разрушение молекулы воды и связывание атмосферного углекислого газа. В реакции из воды высвобождается кислород. Происходит диссоциация воды, и высвобожденный при этом водород принимает участие в фотосинтезе. Основным стабильным продуктом реакции фотосинтеза является фосфоглице-риновая кислота (ФГК). У зеленых растений имеются молекулы-акцепторы, которые связывают двуокись углерода в присутствии соответствующего катализатора (фермента). Конкретно такой молекулой-акцептором является пентоза. Это сахар, который имеет пять атомов углерода. Он называется рибулозо–1,5-дифосфат. В процессе фотосинтеза, который представляет собой целую цепочку реакций, атомы углерода переходят из молекулы в молекулу. Эти реакции в основном сходны, но они дают в разных клетках разные органические соединения — углеводы, кислоты, жиры, белки. Очень важным продуктом фотосинтеза является адено-зинтрифосфат (АТФ). С помощью АТФ происходит ряд химических преобразований. Вначале водород, который получается при расщеплении молекулы воды, взаимодействует с карбоксильной группой (СООН) фосфоглицериновой кислоты и образует триозофосфат. Триоза — это сахар с тремя атомами углерода. При этом образуется и вода. После этого триозофосфат полимеризуется в гексозофосфат. Последний претерпевает дальнейшие изменения. Они состоят в следующем. Во-первых, он образует крахмал в процессе дефосфорили-рования. При этом кроме крахмала образуются и другие органические продукты фотосинтеза. Во-вторых, гексозофосфат через цикл Калвина вновь превращается в рибулозодифос-фат, который способен продолжать ассимиляцию СО2. Все эти процессы весьма сложные и не до конца изученные. Но, тем не менее, можно говорить об определенной общности между структурой реагентов фотосинтеза и строением нуклеиновых кислот. Последние имеют в своей основе пентозо-фосфат. Они образуются путем окисления при участии АТФ. При этом одним из промежуточных продуктов является фос-фоглицериновая кислота. Итак, фосфор и ортофосфорная кислота для структуры живого вещества имеют очень существенное значение. Как известно, при дыхании происходить окисление, в результате которого высшие организмы и получают энергию. При окислении происходят процессы, обратные процессу фотосинтеза. Это значит, что образованные при фотосинтезе углеводы в результате ряда последовательных превращений вновь дают СО2 и Н2О. В результате окисления запасенная в углеводах при помощи хлорофилла солнечная энергия высвобождается в виде энергии движения, или же она расходуется на другие жизненные потребности. Но, как мы уже говорили, энергия не обязательно добывается в процессах окисления. Энергия высвобождается и в процессе брожения, при котором углеводы расщепляются на спирты и двуокись углерода. Так что на кислороде свет клином не сошелся. Даже гетеротрофы могут существовать без свободного атмосферного кислорода. Зеленые растения, которые выделяют при фотосинтезе кислород, могут сохранять его внутри своих организмов для дальнейшего использования. Не менее важен азот (N). Без него нельзя образовать белки живых тканей. Установлено, что некоторые бактерии могут усваивать атмосферный азот. Но это не является основным источником азота для растений. Они получают азот из солей аммония и других имеющихся в почве растворимых неорганических соединений азота, которые входят в жизненный цикл. Сера (S) йод (I) ив определенной мере другие неметаллы, например хлор (Cl), фтор (F), кремний (Si) и бор (B), а также некоторые металлы, в том числе и столь редкие, как ванадий (V) и ниобий (Nb), являются жизненно важными для некоторых специальных процессов и тканей. Тем не менее их количество в составе живого вещества незначительно. Вернемся к рассмотрению углеводов, обобщенная формула которых имеет вид Cm(H2O)n. Глюкоза — это сахар, у которого m = n = 6 (гексоза). Она является наиболее универсальным источником энергии, которая высвобождается в органических системах в процессах окисления или брожения. Рибоза тоже является сахаром, у которого m = n = 5 (пен-тоза). Этот сахар как сам по себе, так и с одним потерянным атомом кислорода образует структурную основу нуклеиновых кислот. Эти кислоты содержат в себе запись основных свойств жизни. Наиболее распространенной и наиболее простой органической кислотой является уксусная кислота. Она образуется из двух молекул формальдегида при их соединении и структурной перестройке. Что же касается спиртов, то они образуются при брожении углеводов, главным образом сахаров. Жирные кислоты, как и высшие парафины, содержат цепочки СН, преобразуются путем реакций со спиртом (глицерином) в жиры. Жиры являются сложными эфирами. Перечисленные выше органические вещества служат пищей и содержат в себе запас энергии. Что касается самой жизни, то она сосредоточена в белках и нуклеиновых кислотах. Белки — это полимеры аминокислотных остатков, в сущности, они являются поликонденсатами аминокислот. Процесс поликонденсации является особым видом полимеризации. В результате этого процесса молекулы одного рода соединяются друг с другом с выделением простой молекулы. Чаще всего такой молекулой является молекула воды. Аминокислота получается из органической кислоты, когда один из ее атомов водорода замещается аминогруппой. Глицин является простейшей из аминокислот. Всего же аминокислот 26. Глицин образуется из уксусной кислоты при замещении атома водорода Н группой NH2. Другие аминокислоты содержат более длинные цепочки СН2. В них некоторые атомы замещены по-разному. Однако все они на одном конце имеют группу NH2, а на другом конце они имеют гидроксильную группу СООН. Аминокислота взаимодействует с водой, точнее, она растворяется в воде. При этом NH2 превращается в отрицательно заряженный ион NH2–. Это характеризует основание. Карбоксильная группа дает положительно заряженный ион водорода, то есть протон Н+. Это и является признаком органической кислоты. Из сказанного выше следует, что аминокислота с одного конца проявляет свойства основания, а с другого — свойства кислоты. Одинаковые или разные две молекулы аминокислоты могут объединяться друг с другом в реакции нейтрализации. Этот процесс подобен процессу соединения кислоты и основания, в результате которого появляются соль и молекула воды. Образованная при этом молекула тоже является аминокислотой с аминогруппой на одном конце и карбоксильной группой — на другом. Это значит, что описанный процесс мог бы продолжаться почти бесконечно. Но он обрывается из-за того, что очень большие полимеры становятся неустойчивыми при обычных температурах и давлении. Когда организмом усваивается белок, то происходит обратная реакция, которая называется гидролизом. В результате этой реакции выделяется молекула воды, а молекулы первоначальных кислот, соединенные пептидной связью, разрываются и становятся самостоятельными. Но затем они снова соединяются, но в этом случае они образуют уже другие белки, в которых нуждается организм. Такое соединение молекул аминокислот может быть вызвано, например, увеличением давления. Роль белков в живом организме известна. Они составляют основную часть цитоплазмы клеток. Некоторые из белков, которые называют ферментами, являются растворимыми. Они способствуют усвоению организмом других веществ. Ферменты участвуют в реакциях, но сами в конце концов восстанавливаются. Так, гормоны, которые регулируют скорость протекания жизненных процессов (это рост, содержание сахара в крови, метаболизм и др.), тоже являются белками. Но еще более важными для организма являются нуклеиновые кислоты. В них входит сахар — пентоза (рибоза или дезоксирибоза). Кислота называется рибонуклеиновой (РНК) или дезоксирибонуклеиновой (ДНК). Сахар может участвовать в процессах нейтрализации и с кислотой, и с основанием, потому что в молекуле сахара имеются Н и ОН, которые способны реагировать как с кислотой, так и с основанием. В ДНК имеются, как правило, четыре основания. Это два пурина (аденин и гуанин) и два пиримидина (цитозин и 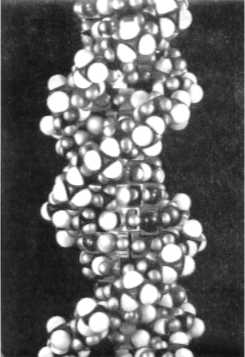
тимин). Правда, сообщалось, что в ДНК находили и более четырех оснований. Травы содержат 5-ме-тил-цитозин. У бактерий и фагов в ДНК имеются другие основания. В РНК тимин заменен ура-цилом. ДНК сосредоточена в ядре клетки. Там же содержится около одной десятой РНК, которая находится в клетке. Остальные девять десятых РНК клетки находятся в цитоплазме. Что собой представляют нуклеиновые кислоты по своей структуре? Это пентозофосфатная цепочка с присоединенными сбоку в различной последовательности четырьмя органическими основаниями. Число возможных перестановок огромное, поскольку цепочка очень длинная. Пространственная структура ДНК и РНК особая. Каждая из молекул скручена в две спирали (знаменитая «двойная спираль»). Эти спирали имеют несколько тысяч витков. Они соединены между собой водородными мостиками, как это показано на рисунке 2. Это чем-то напоминает винтовую лестницу. Порядок расположения атомов в ДНК и РНК уникален для каждого организма и для каждой пары хромосом организма. Что касается многочисленных организмов, то их ДНК, находящаяся в немногих хромосомах, содержит полный план строения индивидуума для его развития из одной-единственной клетки. Ученые полагают, что меняется только порядок нуклеотидов. Из этого делается вывод, что генеральный план строительства будущего организма записан своего рода четырехбуквенным кодом. Правда, при этом упорно не учитывается (или даже отрицается) роль полевых структур организма. О роли этих структур мы писали в книгах «Бог, душа, бессмертие» и «Тайна мирового разума». Но надо отдать должное ученым, что при этом они сознают сложность данной проблемы. «Основные элементы жизни очень просты и имеют химическую природу. Но процессы размножения, индивидуального роста и эволюции видов столь запутанны и сложны, что их чисто механическая интерпретация почти невозможна. В этих процессах, по-видимому, участвуют воля и цель, какой бы смысл ни вкладывался в эти понятия», — говорится в одном из научных трудов. Одними ДНК с их химической трактовкой все объяснить принципиально нельзя. Предлагается ввести понятие психической субстанции, которая количественными соотношениями была бы связана с энергией и веществом, то есть с физическим миром. На самом деле все и проще, и сложнее. Проще в том смысле, что не только индивидуум, но и вся Вселенная создавалась по предварительно заданному плану. Сложнее потому, что надо рассматривать не психическую субстанцию отдельного индивидуума, а информационно-биологическое поле Вселенной и поля (формы-голограммы) каждого индивидуума. Важно понять связь между ними, связь информационно-биологического поля с полем каждого индивидуума через его подсознание. Только рассматривая всю Вселенную как замкнутую единую систему, мы можем правильно решать проблемы, касающиеся отдельных элементов этой системы, в частности, отдельных индивидуумов. Тогда не придется придумывать искусственных схем вроде той, в которой «молекула ДНК может быть простейшим физическим аппаратом, вырабатывающим психическую субстанцию или реагирующим на нее, то есть действующим как миниатюрный мозг». Именно такие рассуждения уводят ученых в сторону от истины. Мы тут только добавим, что мысль нельзя связывать только с мозгом. Она тоже имеет полевую структуру, процесс мышления пространственно не ограничивается пределами мозга и даже всего тела человека. Спиральная структура характерна не только для нуклеиновых кислот. Ею обладают и многие белки. Любопытно, что и белки не столько просты и бесхитростны. Их свойства и функции определяются не только химическим составом, но и их пространственной конфигурацией (как изогнуты и закручены их молекулы). Полипептидные цепочки обычно не являются прямыми. Правда, некоторые простые белки в растворе могут раскручиваться. Чаще всего они или свернуты в шарики, или же образуют открытые спирали, которые скреплены водородными или иными мостиками. Например, белок животной соединительной ткани коллаген состоит из длинных волокон, которые закручены в спиральные витки. Это создает упругость конструкции (но не только). Так, тонкая прозрачная пленка, которая покрывает тело дождевого червя и защищает его от высыхания (кутикула), состоит из переплетенных волокон коллагена, которые напоминают (если их разглядывать под электронным микроскопом) хлопчатобумажную ткань. Похожие структуры образует и мышечный белок миозин. В ответ на электрические импульсы он сокращается. Такой белок очень универсален. Жгутики, при помощи которых передвигаются некоторые простейшие и мужские половые клетки, могут состоять только из одной молекулы такого белка. ДНК, которая находится в хромосоме, существует там не в виде одиночного волокна, а имеет форму двух цепочек, которые являются зеркальным отображением одна другой. Они обе закручены в двойную спираль и соединены между собой водородными связями. В сущности, за исключением бактериальных клеток ДНК полностью сосредоточена в хромосомах ядра клеток. Там она находится в соединении с белком. Что собой представляет хромосома? Это нитевидное тельце, свернутое в спираль. Но эта спираль способна распрямляться и, более того, — принимать различные формы. Хромосома может принимать форму прямой линии, она может принимать форму V. В определенных условиях она сплетается с другими хромосомами в рыхлый клубок. Хромосомы в обычной клетке существуют парами. Это состояние специалисты назвали диплоидным набором («ди» значит «два»). Если хромосомы непарны, это называют гаплоидным набором, который встречается редко. У каждого вида число хромосом вполне определенное. Так, например, у человека имеется 46 хромосом. При этом все живые клетки в организме содержат одно и то же число одинаковых хромосом. Это не зависит от формы и размеров тела. Каждая из этих хромосом только немногим сложнее единичной крупной молекулы. В состоянии покоя хромосомы отдыхают. Они свернуты в комочек. Но накануне деления клетки в ее ядре начинается бурная деятельность. Хромосомы начинают «работать». Каждая из них образует себе подобную. Поэтому их число удваивается. Когда этот процесс размножения завершается, хромосомы совершают торжественный танец, в результате которого они расходятся в противоположные концы ядра для того, чтобы ядро могло разделиться на две части, на два новых ядра. Тогда в каждом новом ядре будет по одной хромосоме. Цитоплазма ведет себя подобным образом — готовится к разделению. В результате нитка делится на две одинаковые дочерние клетки. Это показано на рисунке 3. Такое разделение является бесполым. Оно называется митозом. Таким бесполым путем размножаются простые одноклеточные организмы. Более того, так происходит и процесс роста. Но при росте новые клетки в различных тканях могут претерпевать значительные структурные изменения. Из всего сказанного следует один принципиальный вывод: хромосомы, а значит, и белок и ДНК в них могут воспроизводить сами себя. Полагают, что именно ДНК действует как шаблон для построения другой молекулы ДНК. Так же происходит в кристалле надстройка кристаллической решетки. Очень важна двойная зеркальная структура молекулы, поскольку каждая цепочка пары образует свое зеркальное отражение. С белком ядра происходит то же самое. В белке ядра расстояния между составными частями совпадают с расстояниями между нуклеотидами ДНК. Поэтому при удвоении образуется целая хромосома. Этого не могло произойти в том случае, если бы хромосома состояла только из одиночной молекулярной цепочки. Подчеркнем, что подобная двойная структура распространяется и на хромосомы. Хромосомы тоже живут парами. Правда, две хромосомы одной пары не являются зеркальным отражением одна другой. Более того, они несколько отличаются друг от друга. 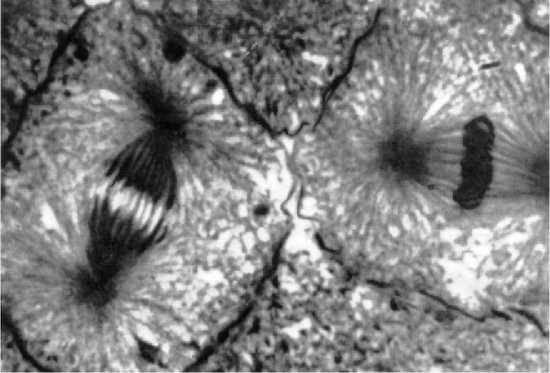
Разница между обычной кристаллизацией и самовоспроизведением ДНК состоит в том, что образовавшаяся молекула ДНК, в отличие от завершенного ряда кристаллической решетки, отделяется. Она в одиночестве совершает свой танец. Поэтому здесь не может идти речь об одной голой химии. Опыты показали, что ДНК и РНК принимают участие в синтезе белков. При этом ДНК управляет, а РНК исполняет. РНК плазмы синтезируется при помощи ДНК. Она является переносчиком РНК, которая ответственна за синтез белков. Правда, было найдено, что в синтезе белков участвует что-то еще кроме четырех нуклеотидов РНК. Это «что-то» присутствует в столь малых количествах, что его трудно выделить и определить, что же оно собой представляет. Но, хотя информация для производства белков считывается с РНК, свойства этих белков определяет ДНК. Собственно, ничего удивительного в этом нет — ведь сама РНК создается при помощи ДНК. Опытным путем был установлен следующий любопытный факт: синтез белков прекращается, если удалено 85 % нуклеиновых кислот. Этот синтез возобновляется, если ввести вновь РНК. ДНК в чистом виде можно выделить из бактерий, которые вызывают воспаление легких. Эти бактерии называются пневмококками. Они существуют в нескольких разновидностях, у которых различные характеристики. Так, в одной из разновидностей этих бактерий их группы заключены в общую защитную капсулу. Было установлено, что если эту выделенную ДНК ввести в культуру пневмококков, которые не заключены в капсулы, то подвергшееся «прививке» поколение бактерий само начинает создавать капсулы. Более того, это свойство передается потомству без добавочного введения ДНК из той разновидности бактерий, которые образуют капсулы. При этом постоянным наследственным свойством этих бактерий становится образование ими капсул. Проследить функции ДНК можно на примере какого-либо вируса, например бактериофага кишечной палочки Т2. Этот вирус состоит из белковой оболочки, которая заключает в себе одну молекулу хромосомной ДНК. Эту молекулу специалисты называют «апериодическим кристаллом» то есть кристаллом, у которого нет четкого периода, повторяемости. По весу ДНК и белок составляют 40 и 60 % соответственно. Кроме белка и ДНК в этом вирусе имеются также следы липоидного вещества. Таким веществом являются кислоты в соединении со спиртами. ДНК вируса имеет необычный состав. Она включает в себя 5-гидроксиме-тилцитозин. Оболочка вируса состоит из головки призматической гексагональной формы, которая заключает в себе ДНК, и трубкообразного хвостика или ножки. Ножка обвита белковыми волокнами, которые образуют на конце ножки своего рода усики. Эти усики весьма уникальные — они способны «узнавать хозяина». Атомные структуры усиков соединяются со стенками одних клеток и не соединяются со стенками других клеток. Поэтому если вирус встретится с нужным типом клетки, то его усики прикрепляются к этой клетке. Благодаря этому мосту ДНК из вируса переходит в канал ножки. Затем она делает дырку в стенке клетки и через нее проникает в цитоплазму бактерии. Пустую оболочку ДНК оставляет снаружи клетки, в которой она поселилась. Ей эта оболочка больше не нужна. Кстати, пустая оболочка во всех отношениях мертва. Она не может размножаться, что свойственно живому веществу. Правда, эта неживая оболочка способна присоединяться к соответствующей бактерии и убивать эту бактерию. Бактерия погибает потому, что в ней подавляется синтез белков. Поэтому наступает ее смерть. Таким образом, вся сущность вируса заключена в его ДНК. Эта ДНК вируса побеждает управляющее действие ДНК бактерии. Кроме того, она перестраивает все доступное ей вещество бактерии по своему образу и подобию. Так создаются отдельные нити вирусной ДНК. Через короткое время они образуют белковые оболочки. При этом внутри разрушенной клетки-хозяина рождается новое поколение вирусов. Подобным образом происходит заражение гусеницы личинкой наездника. Но это только внешнее сходство. Ведь образованный вирус не развивается. Ученые говорят, что у вируса нет метаболизма. Он все время остается неизменным. В сущности, вирус — это кристалл, но паразитический. В некоторых отношениях он отдаленно напоминает мужские половые клетки — гаметы. Правда, мужские половые клетки высших многоклеточных организмов, в том числе и человека, обладают и другими свойствами. Так, мужской сперматозоид состоит из белковой оболочки, в которой находится набор хромосом без цитоплазмы, и жгутика, при помощи которого он движется. Головка и хвостик как и у вируса. Что касается женской яйцеклетки, то она сравнительно велика и в ней много цитоплазмы. Гаметы размножаются простым редукционным делением, или мейозом. При этом хромосомы каждой пары разделяются. В результате дочерние клетки имеют половину нормального числа хромосом. У человека их 23. Они являются гаплоидными клетками. Когда происходит слияние мужской и женской гамет, то образуется одна диплоидная клетка с полным набором хромосом и цитоплазмой. Сразу же после этого происходит митоз. В результате каждая пара, которая была образована соответствующими хромосомами сперматозоида и яйцеклетки, воспроизводит себе подобную. Эмбрион начинает расти и развиваться. Вся информация о свойствах нового организма содержится в ДНК. Сама же наследственность передается неделимыми «партиями» (в физике порции энергии называют квантами). Эти кванты называют генами. Поскольку в клетке имеются два набора хромосом, то и гены там имеются в двух экземплярах. Такие парные гены называются аллелями. Случаи бесполого развития неоплодотворенных яиц высших организмов очень редки. В результате этого процесса получаются гаплоидные особи. Примером таких гаплоидных особей являются трутни. Это по сути гаплоидные пчелы, которые развились из неоплодотворенных яиц. Процесс может развиваться и по-другому: одно яйцо может быть оплодотворено двумя или более сперматозоидами. При этом образуется аномальная особь, у которой вместо двух будет три или больше наборов хромосом. В этих ненормальных условиях эмбрион будет развиваться более или менее нормально. Но избыток хромосом неизбежно приведет к различным отклонениям и неправильностям. Известно, что болезнь Дауна вызывается именно наличием третьего набора хромосом. Несмотря на все это «супружество» аллелей может быть удачным. Если они одинаковы, то ничего плохого не произойдет. В результате потомство будет характеризоваться тем же геном. Независимо от того, как распределены хромосомы в процессе мейоза, один аллель всегда будет присутствовать. Если же два аллеля различны, то возможны два варианта. Или они будут сотрудничать и оказывать на особь совместное влияние, или же они будут антагонистами. В последнем случае один ген (доминантный) будет господствовать над другим, подавляя его. Этот подавленный ген называют рецессивным. Но этот подавленный ген не сдается. Он ждет благоприятного случая для своего высвобождения. Это вполне возможно при следующем мейозе. В том случае, если гены несовместимы, их союз остается бесплодным. Ген в хромосоме занимает определенное место. Его можно проследить вплоть до химического состава части молекулы ДНК. Это показано на рисунке 4. Если гаметы мухи дрозофилы подвергнуть радиоактивному облучению, то можно наблюдать, как на ее потомство будет влиять повреждение какой-либо части хромосомы. 
Понимание и объяснение механизма наследственности базируется на факте существования генов в двух экземплярах. Однако было установлено, что не все наследуемые характеристики передаются по наследству через хромосомы, как это представляется законами Менделя. Оказалось, что цитоплазма тоже может принимать участие в передаче наследственных признаков. Но мужская гамета не имеет цитоплазмы. Поэтому цитоплазменная наследственность обычно ограничена женской линией. Но и это не все. На самом деле все намного сложнее. Сложнее потому, что некоторые плазмогены, то есть единицы неменделевской наследственности, могут быть «заразными». |
|
||
|
Главная | В избранное | Наш E-MAIL | Прислать материал | Нашёл ошибку | Верх |
||||
|
|
||||
